Gene als Medizin
WAS MRNA-WIRKSTOFFE HEUTE SCHON KÖNNEN UND WAS DIE ZUKUNFT BRINGT
Seite 1/1 13 Minuten
Heutzutage hat wahrscheinlich der ein oder andere Grundschüler das Wort Ribonucleinsäure schon mal gehört und kann es sogar fehlerfrei aussprechen. Das war vor ein paar Jahren noch anders: Aus dem Biokurs wussten viele natürlich auch vor Corona schon, dass es sich bei der messenger-Ribonukleinsäure mRNA um eine Kopie der Desoxyribonukleinsäure, kurz DNA, handelt – also von Teilen des im Zellkern ruhenden Erbmaterials.
Dass man jedoch aus solch filigranen Fäden irgendwann einmal Impfstoffe und Arzneimittel herstellen würde, ahnten sicherlich nur ein paar handverlesene Wissenschaftler.
Was sind DNA und RNA?
Beginnen wir am Anfang. Hier steht die DNA, unsere Erbinformation, die in Chromosomen gepackt im geschützten Zellkern aufbewahrt wird. Diesen kann sie nicht verlassen, weil sie chemisch zu instabil und außerdem für den Körper zu wertvoll ist. Man würde ja auch seinen Original-Reisepass nicht mit der Post verschicken, sondern lieber eine Kopie.
Gleiches tut gewissermaßen unsere Zelle: Bestimmte Abschnitte der DNA werden durch ein Enzym, die RNA-Polymerase, in RNA umgeschrieben. Diesen Vorgang nennt man Transkription. Die Kopie kann dann den Zellkern verlassen und im Cytosol, dem flüssigen Zellinhalt, an Ribosomen zu einer Aminosäurekette übersetzt werden – man spricht von der Translation.
Wie sich DNA und RNA unterscheiden: Verschiedene Zucker und eine andere Base
DNA (Desoxyribonukleinsäure) und RNA (Ribonucleinsäure) bestehen aus Ketten sogenannter Nucleotide. Sie sind aus einem Phosphatrest, einem Zuckermolekül und einer organischen Base zusammengesetzt. Während die DNA aus den Basen Cytosin, Thymin, Adenin und Guanin besteht, enthält die RNA statt Thymin die Base Uracil. Außerdem ist der Zucker der DNA-Nucleotide Desoxyribose, in der RNA Ribose.
Von der DNA zum Protein
Die DNA besteht aus einzenen Abschnitten, den Genen. Diese enthalten jeweils die Information für einzelne Proteine. Jedes Gen hat einen definierten Anfang und ein Ende, das eindeutig durch bestimmte Basenfolgen gekennzeichnet ist. Der Anfang eines Gens heißt Promotor, das Ende Terminator. Die RNA-Polymerase erkennt den Promotor, bindet dort und beginnt damit, die DNA-Stränge zu trennen und den sogenannten codogenen Strang in RNA zu übersetzen. Der andere Strang wird nicht transkribiert.
Die bei dieser Transkription entstandene prä-RNA muss vor dem Verlassen des Zellkerns noch bearbeitet werden: das ist das RNA-Processing. Erst danach kann die nun reife RNA ihre Aufgaben übernehmen. Dies geschieht auf verschiedene Weise und dient unter anderem auch dazu, verschiedene RNA-Typen zu produzieren.
Während des Processings wird die RNA durch verschiedene Reaktionen verändert:
- durch Capping (Anhängen eines methylierten Guanin-Nucleotids ans 5‘-Ende der RNA - das ist das vordere Ende),
- durch das Anheften eines Poly-A-Schwanzes (bestehend aus rund 200 Adenin-Nucleotiden am 3‘-Ende - das ist das hintere Ende)
- sowie das Spleißen, bei dem RNA-Stücke zerschnitten und neu zusammengefügt werden.
Cap und Poly-A-Schwanz stabilisieren die Boten-RNA und schützen sie so für eine gewisse Zeit vor dem enzymatischen Abbau. Beim Spleißen werden Bruchstücke aus der prä-RNA entfernt. Ein Gen besteht nämlich aus codierenden Abschnitten, den Exons, und nichtcodierenden, die für die Herstellung eines bestimmten Proteins nicht abgelesen werden, Introns genannt. Beide wurden aber transkribiert und deshalb müssen beim Spleißen die Introns entfernt und die verbleibenden Exons miteinander verbunden werden.
Die snRNA bestimmt, wo geschnitten wird. Das Spleißen ist deshalb erforderlich, weil unsere Gene jeweils die Information für verschiedene Eiweiße enthalten. Je nachdem, welches Produkt, also welches Eiweiß, gerade gebraucht wird, können aus dem gleichen Abschnitt durch unterschiedliches Spleißen verschiedene Eiweiße hergestellt werden (alternatives Spleißen).
RNA-Typen
+tRNA: Transport-RNA; transportiert Aminosäuren in der benötigten Reihenfolge ans Ribosom
+mRNA: messenger- oder Boten-RNA; wird in eine Aminosäurenkette translatiert
+rRNA: ribosomale RNA; die Moleküle bilden zusammen das reaktive Zentrum des Ribosoms
+siRNA: small interfering RNA; Bruchstücke, die der Genregulation dienen
+miRNA: micro-RNA; dient ebenfalls der Genregulation
+snRNA: small nuclear RNA; kleine Kern-RNA-Moleküle, die Spleißstellen erkennen und die Reaktion katalysieren
Ein ausgeklügeltes Regulationssystem
Unsere Gene werden nicht alle gleich oft transkribiert. Die Genprodukte (RNA oder Proteine) produziert die Zelle dem Bedarf angepasst. Unsere Zellen besitzen mehrere unterschiedliche Mechanismen für diese Genregulation. Die Transkription kann grundsätzlich erst starten, wenn an den Promotor des entsprechenden Gens weitere Transkriptionsfaktoren gebunden haben. Dies sind unterschiedliche Eiweiße.
Neben allgemein notwendigen Faktoren gibt es Aktivatoren (Enhancer) und Inhibitoren (Silencer). Diese ermöglichen eine praktisch stufenlose Regulation des entsprechenden Gens in seiner Aktivität, von höchstmöglicher Transkriptionsrate bis zur völligen Deaktivierung.
Ein weiterer Mechanismus der Genregulation besteht in der sogenannten RNA-Interferenz. Hiermit ist eine Methode gemeint, mit der unser Organismus bestimmte Gene gezielt stilllegt. Das machen sich zum Beispiel manche Pflanzen zunutze, die von Viren befallen wurden. Die doppelsträngige Virus-RNA wird durch ein spezielles Enzym in kleine Bruchstücke zerlegt (siRNA). Die Pflanzenzelle erkennt und trennt diese Stränge und stellt dann den zur Virus-RNA entgegengesetzten Strang her.
Diese Reaktion ist der Start für die Pflanzenzelle, die Virus-RNA abzubauen. Die Infektion stoppt. Die in befallenen Zellen hergestellte si-RNA kann nun auch in andere, gesunde Zellen der Pflanze gelangen und diese vor dem Virus schützen. Weil die von der Pflanze gebildete siRNA gegensätzlich, also komplementär zum Gen des Virus ist, nennt man diese Technologie Antisense. Sie findet bereits seit Längerem bei Arzneimitteln Anwendung.
Der dritte Mechanismus der Genregulation ist die posttranskriptionelle Regulation. Sie findet nach der Transkription statt. Das menschliche Genom enthält die Information für rund 1000 verschiedene Micro-RNAs (miRNA). Sie regulieren ungefähr 30 Prozent unserer Gene. Diese doppelsträngige RNA bindet an reife mRNA und bewirkt dort deren Abbau, ähnlich wie siRNA. Auch so kann die Art und Menge der hergestellten Proteine reguliert werden.
RNA als Wirkstoff in Arzneimitteln und Impfstoffen
Mit den Corona-Impfstoffen von BioNTech und Moderna hat man nun zum ersten Mal ein externes mRNA-Molekül in den Körper injiziert. Mit diesem mRNA-Molekül stellen die menschlichen Ribosome die viralen Proteine her, die dann als Antigen dienen. In diesem Falle handelt es sich um das Spike-Protein, mit dem SARS-CoV-2 in die menschlichen Zellen eindringt.
Das klingt einfach, ist aber in Wirklichkeit sehr kompliziert. Unsere Zellen haben aus gutem Grund Abwehrmechanismen gegen fremde RNA. Es war ein weiter und sehr steiniger Weg, herauszufinden, wie das empfindliche RNA-Molekül nicht nur in die menschliche Zelle gelangen kann, ohne abgebaut zu werden, sondern auch, ohne eine Immunreaktion als Fremdkörper auszulösen. Tausende Menschen haben dafür jahrzehntelang an scheinbaren Kleinigkeiten geforscht. Jede einzelne dieser Kleinigkeiten bildet ein Puzzleteil, die zusammen diesen großen Erfolg möglich machten.
Probleme und Lösungsversuche
Die Forschung an RNA, ihren Eigenschaften und therapeutischen Einsatzmöglichkeiten ist hochkompliziert. Oft wird Zeit und viel Geld in vielversprechende Substanzen investiert, um dann doch an einem unüberwindbaren Problem oder mangelnder Wirksamkeit in klinischen Studien zu scheitern. Aber was macht es so schwierig, aus RNA ein Medikament zu entwickeln?
Problem 1: Stabilität
Zunächst das Problem der Stabilität: Die RNA ist von Natur aus als kurzlebige, wenig wertvolle Kopie der DNA angelegt. Um Energie zu sparen, ist sie aus der instabileren Ribose und aus dem chemisch weniger aufwendigen Uracil (statt Thymin) aufgebaut. Hat es seine Aufgabe erfüllt, wird das Molekül durch Enzyme zerlegt. Zu hohe Stabilität und damit zu lange Haltbarkeit würde dazu führen, dass die Proteinsynthese nicht fein genug dem Bedarf der Zelle angepasst werden kann. Will man RNA allerdings therapeutisch nutzen, muss man sie stabiler und in ihrer Wirkdauer berechenbar zu machen.
Dieses Problem wurde weltweit mit unzähligen Modifikationen angegangen. Eine davon bestand aus dem Einbau eines Schwefel-Atoms in das Phosphat-Rückgrat der Oligonukleotide. Trotz der teilweise hohen Toxizität der entstandenen Substanzen wurde 1999 das erste Arzneimittel auf Basis der Technologie auch in Europa zugelassen.
Bei der chemischen Veränderung muss eine Balance gefunden werden: Wenn eine Veränderung chemisch vorteilhaft ist, kann sie toxische Effekte verstärken oder die Bindungsfähigkeit an die Ribosomen ungünstig beeinflussen. Unser Körper ist jedoch viel komplexer als jeder Versuchsaufbau. Daher fehlt den Wissenschaftlern auch die – mittlerweile in der Arzneistoffentwicklung unverzichtbare – Unterstützung durch Computermodelle, die die Strukturen der Moleküle auch dreidimensional berechnen können.
Die Prozesse in den Zellen können Modelle aber nur unzureichend darstellen und vieles weiß man auch schlicht noch nicht. Das macht die Forschung an diesen Arzneistoffen so zeitraubend, kleinteilig und teuer. Rückschläge und Sackgassen sind an der Tagesordnung.
Problem 2: Ein Wächter reagiert auf fremde RNA
Eine weitere Problematik betrifft die Immunogenität: Unser Immunsystem besitzt ausgeklügelte Mechanismen, um sich gegen Eindringlinge wie RNA-Viren zu wehren.
Zellen beschaffen sich unter anderem über Endozytose verschiedene notwendige Substanzen. Binden sie an einen Rezeptor auf der Zellmembran, löst dies das Einstülpen der Membran nach innen aus. So kann ein aufzunehmendes Molekül ins Cytosol transportiert werden. Auf der Zellmembran sitzen jedoch Wächter-Rezeptoren, die das angeborene Immunsystem aktivieren, wenn der Inhalt der Einstülpung (Endosom) als fremd erkannt wird. Diese heißen Toll-like Rezeptoren (TLR).
Im Falle von fremder RNA werden sie umgehend aktiviert und stoppen über eine Signalkaskade die Proteinsynthese in der Zelle. Die Zelle schüttet Interferone und Zytokine aus und stirbt ab. Das führt unter Umständen zu einer unkontrollierten Immunreaktion, die dazu dienen soll, den Fremdkörper abzuwehren. Diesen Prozess muss man bei RNA-Therapeutika verhindern.
Das Problem der Immunantwort über die TLR löste in den 2000er Jahren eine Forschungsgruppe, die dafür später vielfach ausgezeichnet wurde. Die entdeckte Technologie ebnete den Weg für die heute eingesetzten RNA-Impfstoffe gegen SARS-CoV-2. An ihrer Entwicklung beteiligte sich auch die Wissenschaftlerin Katalin Karikó, die danach bei BioNTech am erfolgreichen RNA-Impfstoff forschte.
„Wenn man nichts hat, gibt einem das die Freiheit, furchtlos zu sein.“ – Katalin Karikó
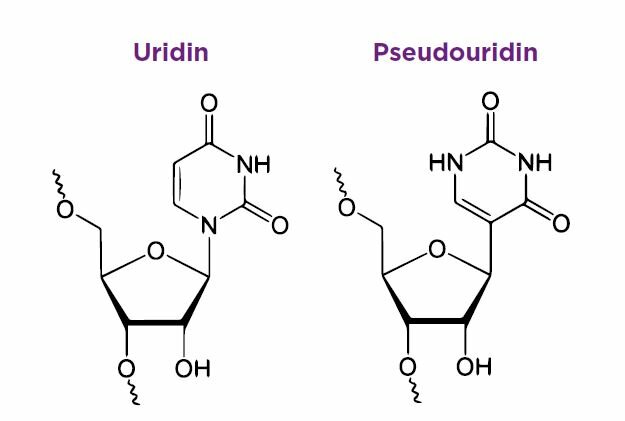
Die Lösung stellte sich als verhältnismäßig einfach heraus: Um die Aktivierung der TLR zu verhindern, ohne gleichzeitig die Proteinsynthese zu beeinträchtigen, musste die Raumstruktur der RNA leicht verändert werden. Dadurch bindet die modifizierte RNA zwar an TLR, aktiviert sie aber nicht. Die Translation an den Ribosomen ist von der Veränderung nicht betroffen.
Die Wissenschaftler ersetzten Uridin durch das Isomer Pseudouridin, ein natürlich vorkommendes Nucleosid. Daneben wurde auch die Methylierungen von Uridin oder Cytidin erprobt. Methylierungen von DNA führt der Körper übrigens auch selbst durch, um sie vor Abbau zu schützen. Die so veränderte RNA ist deutlich weniger immunogen.
Problem 3: elektrische Ladung
Die dritte Barriere ist die Ladung der RNA-Moleküle. Es handelt sich um sehr große, vielfach negativ geladene Moleküle. Die Größe, aber vor allem die Ladung verhindern das Eindringen in Zellen, weil das Cytosol stets leicht negativ geladen ist. Freie RNA würde also geradezu abgestoßen.
Auch diese Barriere ließ sich umgehen: Man verpackte die RNA in Lipiden zu Nanopartikeln. So entstehen ungeladene, stabile Komplexe, die ungiftig sind und durch die Blutbahn wandern können. In ihrem hydrophilen Kern transportieren sie die RNA. Die Lipidhülle wird durch Endozytose in die Zelle aufgenommen und setzt ihre Fracht im Cytosol frei.
Ein Vorteil von Nanopartikeln ist, dass sie durch die Wahl der Lipide oder durch Beschichtung mit Antikörpern oder Zuckerstrukturen gezielt in bestimmte Zelltypen eingeschleust werden können. Das macht sie vielseitig einsetzbar. Zusätzlich schützt die Lipidhülle vor dem Abbau durch im Blut frei vorkommende RNA-abbauende Enzyme.
Wissenschaftler beschäftigen sich auch mit sogenannten Nanocarriern. Hierbei handelt es sich um stark positiv geladene Proteine, die zusammen mit der RNA Membranen überwinden und sie so ins Cytosol bringen können. Oft stellen hierbei allerdings toxische Nebenwirkungen Probleme dar.
mRNA als Arzneimittel
Die Gruppe der Nucleinsäure-Therapeutika ist sehr heterogen und so ist es auch mit ihrem therapeutischen Einsatz. Die am längsten auf dem Markt verwendete Technologie sind die Antisense-Oligonucleotide. Hier handelt es sich um kurze einsträngige RNA-Moleküle, deren Basenfolge entgegengesetzt zur Ziel-RNA gerichtet ist.
Dadurch heften sie sich zielgenau an die gewünschte Sequenz in der Zelle und blockieren die Translation in das entsprechende Protein. So kann man zum Beispiel die Bildung fehlerhafter und potenziell schädlicher Proteine im Körper verhindern, wie sie unter anderem bei genetisch bedingten Stoffwechselerkrankungen entstehen. Außerdem kann man die Antisense-Moleküle gezielt gegen Virusmaterial richten und so Infektionen bekämpfen.
Ausrangierter Pionier
Das erste, 1999 zugelassene Arzneimittel dieser Art war Formivirsen (Vitravene®), ein Antisense-Nucleotid gegen das Cytomegalie-Virus, das bei HIV-Patienten zur Erblindung führen kann. Es wurde in den Augapfel gespritzt, wurde jedoch aufgrund des mangelnden Bedarfs bereits wieder vom Markt genommen.
Unbezahlbare Hoffnungsträger: Das teuerste Medikament der Welt
2017 wurde Nusinersen (Spinraza®) gegen spinale Muskelatrophie zugelassen. Diese tödliche Erbkrankheit betrifft in Deutschland circa 80 Kinder – ist also relativ selten. Bei den Betroffenen ist ein Gen mutiert, und zwar so, dass ein falsches Spleißen der gebildeten mRNA erfolgt. Sie wird somit unbrauchbar und ein wichtiges Protein kann nicht in ausreichender Menge gebildet werden.
Als Folge gehen wichtige motorische Nervenzellen unter, schließlich kommt es zu Muskelschwund mit Atemlähmung. Spinraza® wird regelmäßig ins Rückenmark gespritzt und sorgt dafür, dass der Fehler beim Spleißen zumindest teilweise korrigiert werden kann und so eine größere Menge an funktionsfähigem Protein gebildet wird. Die Kinder haben dann eine deutlich verbesserte Prognose und eine höhere Lebenserwartung.
Bis zur Zulassung von Onasemnogen-Abeparvovec (Zolgensma®) im Jahr 2020 war Spinraza® mit Kosten von rund 300 000 Euro pro Jahr die teuerste Therapie der Welt. Bei Zolgensma® ist nur noch eine einzige Injektion nötig – Preis: 2,26 Millionen Euro. Hier handelt es sich um eine „echte“ Gentherapie, bei der die DNA für das korrekte Gen über einen Virus-Vektor in die Zelle geschleust wird.
Interferenz gegen Cholesterin und Erbkrankheiten
Das zweite Wirkprinzip ist die RNA-Interferenz oder auch RNA-i-Therapie. Es handelt sich um kurze doppelsträngige RNA-Sequenzen, die Gene mit Hilfe bestimmter Enzyme gezielt blockieren können. Das Prinzip wurde in den 1980er Jahren entdeckt und 2006 mit dem Medizin-Nobelpreis ausgezeichnet. Es gibt mehrere zugelassene Arzneistoffe, zum Beispiel gegen erbliche Stoffwechselstörungen.
Inclisiran (Leqvio®) sei hier als besonderer Vertreter dieser Wirkstoffklasse erwähnt, denn er dient zur Behandlung einer recht weit verbreiteten Erkrankung, der familiären Hypercholesterolämie (FH). Sie zählt zu den häufigsten genetisch bedingten Störungen und kommt in Deutschland etwa bei einem von 500 Einwohnern vor. Die betroffenen Menschen haben, unabhängig von ihrer Ernährung, zu hohe Cholesterinwerte mit den entsprechenden Folgeschäden.
Ursächlich sind Mutationen im Gen, das den Rezeptor für Low Density Lipoprotein (LDL) codiert. Diese Rezeptor-Fehlbildung verhindert, dass das „schlechte Cholesterin“ LDL abgebaut werden kann und führt zu einem krankhaft erhöhten LDL-Spiegel im Blut. Leqvio® greift in den komplizierten Regelkreis ein, indem es die Bildung eines bestimmten Proteins im Cholesterinstoffwechsel verringert und so indirekt den LDL-Abbau beschleunigt. Eine Kombinaion mit Statinen ist möglich.
Milliardenfach bewährt
Einen besonderen Stellenwert bei den Nucleinsäuretherapeutika hat die mRNA selbst. Im Falle der Impfstoffe gegen SARS-CoV-2 von BioNTech und Moderna wird sie, in Lipid-Nanopartikel verpackt, direkt injiziert und sorgt für die körpereigene Herstellung des Antigens, in diesem Falle das Spike-Protein des Virus. Der bahnbrechende Erfolg der RNA-Impfstoffe dürfte den Weg ebnen für viele weitere Impfungen, die auf dem gleichen Prinzip beruhen. Durch den massenhaften Einsatz dieser Technologie konnte gezeigt werden, dass sie sicher und wirksam ist. mRNA lässt sich therapeutisch sehr flexibel einsetzen.
Die Therapeutika könnten
- Proteine ersetzen, die fehlen oder nicht korrekt gebildet werden,
- Antikörper zuführen
- oder die Produktion schadhafter Eiweiße ausbremsen.
- Impfungen gegen alle Arten von Infektionskrankheiten sind denkbar.
- Die Forschung an Therapien gegen Krebs, Herzinfarkt, Parkinson sowie verschiedensten Erbkrankheiten läuft weltweit.
Was bringt die Zukunft?
Die Anzahl der Forschungsprojekte ist riesig. Die Entwicklung von Impfstoffen gegen die unterschiedlichsten Erkrankungen hat einen hohen Stellenwert. So will Moderna noch im ersten Halbjahr 2023 die Zulassung eines Impfstoffes gegen Humanes Respiratorisches Synzytial-Virus (RSV) bei älteren Menschen beantragen. Ein Impfstoff für Kinder ist noch in der Erprobung. Er könnte einer Überlastung der Kinderkliniken durch schwere Verläufe gerade bei kleinen Kindern vorbeugen.
Gegen Malaria, Ebola, Zika, Tollwut, Eppstein-Barr-Virus, Gelbfieber, Grippe und Cytomegalie sind ebenfalls Impfstoffe in unterschiedlichen Phasen der klinischen Forschung vertreten. Die Suche nach einem Impfstoff gegen HIV gestaltet sich wegen der hohen Mutationsrate und der dadurch hohen Varianz im Genom des Virus als besonders schwierig. Bisher gelang hier noch kein Durchbruch.
Weiter forschen verschiedene Firmen an einer Krebsimpfung. Hier könnten bestimmte Wachstumsfaktoren, die die Tumorzellen vermehrt ausschütten, als Target dienen. Die T-Zellen des Körpers gehen dann gezielt gegen Bereiche vor, in denen sich die Krebszellen befinden und könnten so Metastasen verhindern. Krebs entsteht durch Mutationen, bei denen jeder Patient seine eigenen Muster aufweist. Bei BioNTech und Moderna wird an patientenindividuellen Impfstoffen gegen Krebs geforscht. Diese sollen es möglich machen, gezielt zu dem einzigartigen Tumor im jeweiligen Patienten passende Antigene zu designen, die dann mittels mRNA-Plattform zur Immunisierung dienen sollen.
Bei Moderna wird eine neuartige Therapie getestet, die Herzinsuffizienz behandeln soll. Es handelt sich bei AZD8601 um die mRNA für den Wachstumsfaktor Vasocendothelial Growth Factor A (VEGF-A). Dieser soll Patienten nach einer Bypass-Operation bei der Regeneration des Herzmuskelgewebes helfen, indem er die Neubildung von Blutgefäßen anregt.
In Tübingen wird derzeit ein Antisense-Molekül gegen Chorea Huntington erforscht, eine Erbkrankheit, die durch Ablagerungen eines durch Mutation fehlgefalteten Proteins entsteht und zu Nervenschäden und zum Tod führt. Hier steht man noch ganz am Anfang.
Abschließend sei erwähnt, dass aktuell verschiedene Studien für inhalative Therapeutika gegen Mukoviszidose durchgeführt werden. Mukoviszidose entsteht durch eine Mutation im Gen für einen Chlorid-Ionenkanal. Diese führt zu unterschiedlichen Problemen wie zähflüssigem Schleim in der Lunge mit daraus resultierender Funktionseinschränkung und chronischen Durchfällen.
Die entsprechenden Wirkstoffkandidaten enthalten die mRNA für den korrekten ChloridIonenkanal. Das Spektrum der möglichen Einsatzgebiete für RNA- basierte Wirkstoffe erscheint grenzenlos. Viele Therapien sind bereits in der Erprobung oder sogar schon zugelassen. Die Forschung schreitet täglich fort – wir dürfen mit Spannung in die Zukunft schauen.