Künstliche Intelligenz
WISSENSCHAFTLICHER DURCHBRUCH DES JAHRES – SO SEHEN UNSER PROTEINE AUS
Seite 1/1 3 Minuten
Den menschlichen Körper kennen Forscher schon ziemlich genau: wie Blutgefäße aussehen, warum Krebs entsteht, welche Zellen für das Sehen wichtig sind. Doch im ganz Kleinen ist das Bild noch nicht so klar. Denn nur von einem eher kleinen Teil unserer Proteine, den Bestandteilen des Körpers, wusste man bislang, wie sie aussehen und was sie genau machen. Doch das ändert sich mit Hilfe künstlicher Intelligenz (KI) gerade rasant.
Grund dafür sind neue Computerprogramme, die dreidimensionale Strukturen von Proteinen mit hoher Genauigkeit errechnen, ohne dass zeitaufwendige und teure Messmethoden nötig wären. Kenne man die Gestalt und damit auch die Funktion der Proteine, ließen sich biologische Abläufe im Körper und Krankheiten besser verstehen, erklärt Andreas Bracher vom Max-Planck-Institut für Biochemie in Martinsried.
Arzneistoffe finden
Auch bei der Suche nach neuen Medikamenten helfe dieses Wissen, so Bracher. So wollen Forscher mit Hilfe des neuen Ansatzes Wirkstoff-Kandidaten entwickeln, die genau auf bestimmte Proteine abgestimmt sind.
Mutationen modellieren
Andere Fachleute nutzen die Software bei der neuen Corona-Variante Omikron. Sie untersuchen Auswirkungen von Mutationen im Erbgut auf die Form des sogenannten Spike-Proteins. Eine geänderte Form könnte dazu führen, dass menschliche Antikörper nicht mehr so gut binden können und der Immunschutz nachlässt.
Wissenschaftlicher Durchbruch des Jahres
Das Fachmagazin Science schätzt den neuen Ansatz für so bedeutsam ein, dass es ihn zum wissenschaftlichen Durchbruch des Jahres gekürt hat. „Der Durchbruch bei der Proteinfaltung ist einer der größten aller Zeiten, sowohl in Bezug auf die wissenschaftliche Leistung, als auch mit Blick auf dadurch mögliche künftige Forschungen“, schreibt Science-Chefredakteur Holden Thorp. Er zieht einen Vergleich zur Genschere Crispr, die die Gentechnik revolutioniert hat.
Proteinstrukturen bislang kaum erforschbar
Proteine sind winzig klein, man kann diese Eiweiße selbst unter dem Mikroskop nicht sehen. Bislang war es deshalb sehr aufwendig und teuer, mit Methoden wie Röntgenkristallographie und Kryoelektronenmikroskopie ihren Aufbau zu erforschen. „Science“ zufolge kann das Entschlüsseln einer einzelnen Proteinstruktur auf herkömmliche Weise Jahre dauern und Hunderttausende Dollar kosten.
„Bei vielen Proteinen des Menschen wusste man deshalb bisher nicht, wie sie aussehen“, sagt MPI-Forscher Bracher. Bislang sind nur für gut ein Drittel der Proteine des Menschen experimentell bestimmte Strukturen in einer Datenbank hinterlegt - in vielen Fällen davon sind auch nur Teilbereiche untersucht.
Fast alle menschlichen Proteine errechnet
Mit den neuen Programmen – AlphaFold and RoseTTAFold – braucht es nun keinen großen Aufwand mehr. Ein Team um den AlphaFold-Entwickler John Jumper, der für die auf künstliche Intelligenz spezialisierte Google-Schwester Deepmind arbeitet, hat bereits Strukturen für fast alle menschlichen Proteine vorgelegt. Das Fachblatt Nature zählt Jumper in seiner aktuellen Top-10-Liste zu den derzeit maßgebenden Wissenschaftlern auf der Welt. Sein KI-gestütztes Programm trainiert sich praktisch selbst mit Hilfe von Datenbanken, in denen bereits erforschte Proteinstrukturen hinterlegt sind.
Wie war das nochmal mit den Proteinen?
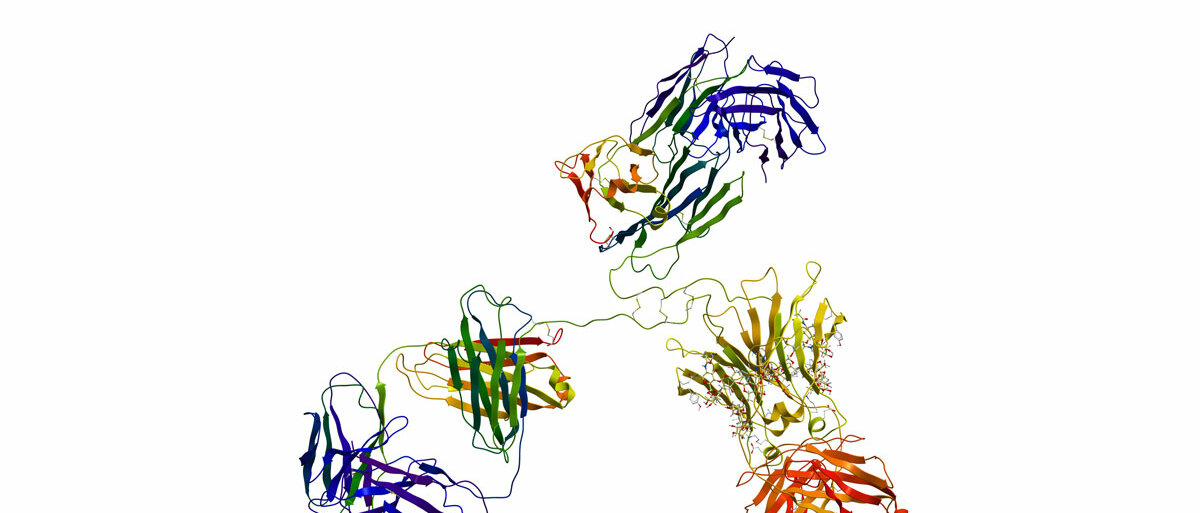
Die Gene unseres Erbguts sind der Code für Aminosäureketten. Jeweils drei Basen auf der Erbsubstanz werden abgelesen, um eine Aminosäure zu bilden, dabei ist die Reihenfolge entscheidend. Diese langen Ketten knäulen sich zu räumlichen Strukturen, den Proteinen zusammen. Wie genau sie sich knäulen, wird durch die chemische Struktur der Aminosäuren bestimmt. Disulfidbrücken, polare Anziehungskräfte und kovalente Bindungen spielen beispielsweise eine Rolle.
Als genau definiertes Knäuel erfüllen die Proteine dann bestimmte Aufgaben. So können manche Proteine als Enzyme Zuckermoleküle spalten oder Stoffwechselvorgänge katalysieren, andere sind Strukturelemente unserer Muskeln.
Aus Aminosäuresequenz Form und Funktion des Proteins errechnen
Kennt ein Forscher ein spezifisches Gen, kann er daraus auf dem Papier oder am Computer die Aminosäurekette eines Proteins ableiten - schon seit Jahrzehnten. Allerdings war es bislang nicht möglich, ohne weiteres die genaue Form und den Aufbau des Proteinknäuels zu bestimmen. „Die ist aber entscheidend, um die Wirkungsweise eines Proteins verstehen zu können“, erklärt Bracher, der selbst mit AlphaFold arbeitet.
Die neuen, für Forscher frei zugänglichen Programme schließen nun genau diese Lücke. Ihnen reicht die durch das Erbgut vorgegebene Aminosäuresequenz eines Proteins, um ein dreidimensionales Modell zu erstellen, wie Bracher erklärt. „Hat man früher Jahre daran gearbeitet, um die Struktur eines Proteins aufzuklären, reicht es jetzt, eine Aminosäuresequenz in den Computer einzugeben.“
Quelle: dpa