Fettstoffwechselstörungen
SCHLEICHENDE GEFAHR
Seite 1/1 19 Minuten
Bestimmung des kardiovaskulären Risikos Das Ausmaß des individuellen kardiovaskulären Risikos des Patienten lässt sich mit Hilfe eines SCOREs (Systematic Coronary Risk Estimation), also eines Risikobewertungssystems, errechnen. Für die Ermittlung des SCORE-Werts existieren verschiedene Modelle. Die aktuellen europäischen Leitlinien der European Society of Cardiology (ESC) und der European Atherosclerosis Society (EAS) favorisieren das SCORE-System ESC, den ESC-SCORE. Ein weiterer, sehr häufig in Deutschland angewandter Algorithmus ist der PROCAM-SCORE (Prospective Cardiovascular Munster Study).
Mithilfe dieser Rechenmodelle lässt sich eine Risikoabschätzung für das Auftreten einer tödlichen Herzgefäßerkrankung innerhalb der nächsten zehn Jahre ermitteln. Sie wird bei Erwachsenen im Alter über 40 Jahre empfohlen, die weder Symptome einer Gefäßerkrankung zeigen noch eine kardiovaskuläre Erkrankung, Diabetes mellitus, Nierenerkrankung oder familiäre Hypercholesterinämie aufweisen. Zur Kategorie der Personen mit einem sehr hohen kardiovaskulären Risiko zählen demnach Personen mit einem mindestens 10-prozentigen Risiko, innerhalb der nächsten zehn Jahre an einem kardiovaskulären Ereignis zu sterben.
Zu dieser Risikogruppe gehören auch immer alle Patienten mit einer dokumentierten kardiovaskulären Erkrankung, also alle Patienten, die bereits einen Herzinfarkt oder Schlaganfall hatten oder an einer anderen Gefäßerkrankung wie einer pAVK leiden. Ebenso haben Patienten mit einer schweren chronischen Niereninsuffizienz (Glomuläre Filtrationsrate (GFR) unter 30 ml/min), Diabetiker Typ II oder Diabetiker Typ I mit Endorganschäden oder einem prominenten Risikofaktor ein sehr hohes kardiovaskuläres Risiko.
Ein hohes Risiko weisen Personen mit einem SCORE zwischen fünf und zehn Prozent auf. Zudem zählen Patienten mit familiärer Hypercholesterinämie, einer ausgeprägten Hypertonie (>180/110 mm Hg), einem Diabetes mellitus ohne Folgeschäden oder Risikofaktoren sowie einer GFR von 30 bis 59 ml/min zu dieser Risikogruppe. Ein moderates Risiko liegt bei einem 10-Jahres Risiko zwischen ein und fünf Prozent vor und ein niedriges Risiko haben alle mit einem 10-Jahres Risiko unter einem Prozent (ohne Risikofaktoren).
Therapieempfehlungen der aktuellen Europäischen Leitlinien Leitliniengerecht sollten Patienten mit einem sehr hohen Risiko für ein kardiovaskuläres Ereignis ihr LDL-Cholesterin auf einen Wert unter 70 mg/dl senken – oder wenigstens um 50 Prozent, wenn der Ausgangswert zwischen 70 und 135 mg/dl liegt. Personen mit einem hohen Risiko wird zu einem Zielwert von bis zu 100 mg/dl geraten – oder wenigstens einer Senkung um 50 Prozent, wenn der Ausgangswert zwischen 100 und 200 mg/dl liegt. Personen mit einem niedrigen oder moderaten Risiko empfiehlt die ESC ein LDL-Cholesterin von bis zu 115 mg/dl. Zu der letzten Risikogruppe zählt die Mehrheit der Erwachsenen.
Wie hoch dürfen Blutfettwerte sein? In der Praxis orientieren sich die Ärzte allerdings nicht immer an den LDL-Zielwerten der ESC. So halten viele Endokrinologen einen Referenzwert bis zu 130 mg/dl für Gesunde ohne Risikofaktoren für ausreichend, einige Praxen legen ihren Therapieentscheidungen sogar noch höhere Werte zugrunde (z. B. bis zu 150 oder 160 mg/dl). Gemäß der aktualisierten Leitlinien der ESC sollten deutlich niedrigere LDL-Zielwerte angestrebt werden.
Demnach soll der Referenzwert für Gesunde ohne Risikofaktoren unter 115 mg/dl liegen, was damit dem der Risikogruppe „niedrig bis moderat“ entspricht. Unabhängig von den LDL-Zielwerten wird für alle Risikogruppen ein hoher HDL-Wert angestrebt. Bei Männern sollten er über 40 mg/dl beziehungsweise 1 mmol/l und bei Frauen über 45 mg/dl bzw. 1,2 mmol/l liegen. Triglyceride: weniger als 150 mg/dl beziehungsweise 1,7 mmol/l und Lipoprotein(a): weniger als 30 mg/dl beziehungsweise weniger als 70 mmol/l.
Zuerst Lebensstil ändern Um die entsprechenden LDL-Zielwerte zu erreichen, müssen in der Regel nicht gleich lipidsenkende Medikamente zum Einsatz kommen. Wichtige Bestandteile des Lidpidmanagements sind neben einem gut eingestellten Blutdruck (unter 140/90 mmHG) und adäquaten Blutzuckerwerten (HbA1c-Wert unter 7 Prozent) die Modifikation des Lebensstils.
In den aktuellen ESC-Leitlinien gehört der Verzicht des Rauchens, mehr körperliche Bewegung (2,5 bis 5 Stunden pro Woche), ein Body-Mass-Index von 20 bis 25 Kilogramm pro Quadratmeter), eine schlanke Taille (maximal 94 Zentimeter (cm) für Männer und unter 80 cm für Frauen) dazu, was eine gesunde Ernährung miteinschließt. Dafür wird eine mediterrane Kost mit viel Gemüse, Obst, Fisch, Olivenöl und Nüssen empfohlen. Diese Kost, die sich durch reichlich pflanzliche Lebensmittel auszeichnet, hat in Studien gezeigt, dass sie die Rate von Herz-Kreislauf-Erkrankungen senken kann.
Ernährung umstellen Eine Veränderung der Ernährungsgewohnheiten steht an erster Stelle, um die LDL-Werte langfristig günstig zu beeinflussen. Grundsätzlich sollten nur so viele Kalorien aufgenommen werden, wie bei Normalgewicht für das Halten des Körpergewichts nötig sind. Übergewicht ist zu vermeiden, da dies einen negativen Einfluss auf das Lipidprofil haben kann. Eine Gewichtsreduktion hingegen hilft, die Blutfettwerte zu verbessern. Vor allem profitieren Übergewichtige mit einer Hypertriglyceridämie.
Da rasch resorbierbare Kohlenhydrate und Alkohol nicht nur für zu viele Kilos auf der Waage sorgen, sondern auch den größten negativen Einfluss auf die Triglyceridwerte im Blut ausüben, sollten diese Lebensmittel auf jeden Fall gemieden oder reduziert werden. Prinzipiell lassen sich durch Umstellung auf eine mediterrane Kost erhöhte Triglyceridwerte und LDL-Spiegel senken. Auch reduzieren mehr Ballaststoffe (mehr als 20 Gramm pro Tag) das LDL im Blut. Ballaststoffe haben einen indirekten lipidsenkenden Effekt durch Reduktion des Fett- und Zuckeranteils in der Nahrung.
Zudem haben sie direktsenkende Effekte auf das LDL-Cholesterin. So binden lösliche Ballaststoffe wie Pektin, Guar, Hafer oder Flohsamenschalen (Psyllium) im Darm aus Cholesterin gebildete Gallensäuren und verhindern damit ihre Aufnahme. Folglich müssen Gallensäuren im Körper neu gebildet werden, wofür Cholesterin verbraucht wird, sodass Gesamt- und LDL-Cholesterinspiegel sinken. HDL lässt sich mit der Ernährung nur schwer beeinflussen. Hingegen gelingt es, mit vermehrter körperlicher Aktivität das HDL-Cholesterin zu steigern.
Optimierte Fettzufuhr Der Anteil von Fetten ist generell maßvoll zu gestalten, das heißt, es sollte fettarm (weniger als 30 Prozent Gesamtfett) mit einem geringen Anteil an gesättigten Fettsäuren (weniger als 10 Prozent der Kalorien) und niedrigen Cholesterinmengen (weniger als 300 mg am Tag) gegessen werden. Auch hat die Auswahl der Fette einen großen Einfluss auf das Lipidprofil. Gesättigte Fettsäuren haben einen LDL-Cholesterin erhöhenden Effekt, da sie die Aktivität der LDL-Rezeptoren an den Leberzellen herabsetzen. Folglich kann zu wenig LDL-Cholesterin aus dem Blut in die Leber aufgenommen werden. Daher ist die Zufuhr gesättigter Fettsäuren zu reduzieren.
Sollten Lebensmittel tierischer Herkunft verzehrt werden, sind fettarme Varianten wie Geflügel, Kalb, gekochter Schinken sowie fettarme Milch, -produkte und Käse vorzuziehen. Zudem sollte sichtbares Fett (z. B. am Schinken, Geflügelhaut, Fleischkrusten) entfernt werden. Einen günstigen Einfluss auf den Fettstoffwechsel üben hingegen einfach und mehrfach ungesättigte Fettsäuren aus, die vor allem in pflanzlichen Lebensmitteln zu finden sind (z. B. in Pflanzenölen wie Raps-, Walnuss-, Lein- oder Olivenöl sowie in Nüssen). Ebenso spielt die Zubereitung der Speisen eine Rolle. So ist das Braten von Lebensmitteln ungünstig, da die dabei aus ungesättigten Fettsäuren entstehenden gehärteten trans-Fettsäuren den LDL-Cholesterinspiegel wie gesättigte Fettsäuren ansteigen lassen. Besser sind fettarme Zubereitungsmethoden wie Garen, Dünsten oder Dämpfen.
Functional Food Wie verschiedene Studien zeigen, kann die regelmäßige Verwendung von mit Phytosterinen angereicherten Lebensmitteln über eine kompetitive Hemmung der Cholesterinaufnahme im Darm das LDL-Cholesterin herabsetzen. Dabei kann der Verzehr von zwei Gramm (g) am Tag eine Senkung um bis zu zehn Prozent bewirken. Da höhere Phytosterinaufnahmen zu keiner weiteren Herabsetzung führen, aber die Resorption von Betacarotin und fettlöslichen Vitaminen hemmen kann, wird geraten, den täglichen Verzehr von Phytosterinen auf drei Gramm zu begrenzen.
Das Bundesinstitut für Risikobewertung (BfR) empfiehlt zudem, Lebensmittel mit einem Zusatz an Pflanzensterinen nur bei nachweislich erhöhtem Cholesterinspiegel zu verzehren, um mögliche gesundheitsschädigende Wirkungen zu vermeiden. Die durch die Ernährung aufgenommene Menge an Phytosterinen aus pflanzlichen Quellen wie Samen, Nüssen oder Hülsenfrüchten reicht in der Regel nicht aus, um eine klinisch wirksame Dosis zu erreichen.
Medikamentöse Lipidsenker Nicht immer sind die erforderlichen LDL-Zielwerte allein durch eine cholesterinbewusste Ernährung und andere Modifikationen des Lebensstils zu erreichen. Vor allem bei erblich bedingten Fettstoffwechselstörungen und beim Vorliegen mehrerer Risikofaktoren beziehungsweise bei einem hohen kardiovaskulären Risiko kann die zusätzliche Einnahme lipidsenkender Medikamente notwendig werden.
Statine als Mittel der Wahl Erste Wahl zur Reduktion des LDL-Cholesterins sind Statine. In Deutschland sind mit Lovastatin, Simvastatin, Fluvastatin, Pravastatin, Atorvastatin, Rosuvastatin und Pitavastin sieben Statine zugelassen, wobei Pitavastatin nicht mehr vertrieben wird. Die Wirkstoffe unterscheiden sich in ihrer Wirkpotenz, ihrer Verträglichkeit und dem Potenzial für Wechselwirkungen. Alle Statine hemmen das Schlüsselenzym der endogenen Cholesterin-Synthese, die Hydroxy-methyl-glutaryl-CoA-Reduktase (HMG-CoA-Reduktase), sodass weniger Cholesterin in der Leber entsteht.
Die Statine werden daher auch als HMG-CoA-Reduktase-Hemmer oder CSE-Hemmer (Cholesterin-Synthese-Enzym-Hemmer) bezeichnet. Der Organismus reagiert auf die Enzymhemmung mit einer ge- steigerten Produktion von LDL-Rezeptoren, die vermehrt zirkulierende LDL-Partikel aus dem Blut aufnehmen. Folge ist eine dosisabhängige Senkung des Gesamt- und LDL-Cholesterins. Zudem wird die Bildung von HDL verstärkt und die Triglyceride nehmen ab. Zusätzlich sind HMG-CoA-Reduktase-unabhängige Mechanismen (pleiotrope Effekte) bekannt.
Zu diesen Zusatzeffekten gehören die Beeinflussung der Blutgerinnung, des Knochenstoffwechsels und Entzündungsreaktionen. Eventuell haben sie auch eine positive Wirkung auf die Entwicklung einer Demenz. Dieser Aspekt bedarf aber noch weiterer Forschungsaktivitäten. Da die Statine besonders effizient den Cholesterinspiegel senken und in der Regel gut verträglich sind, empfehlen die Leitlinien der ESC, ein Statin bis zur höchsten empfohlenen Dosierung zu verordnen. Besonders potent sind Rosuvastatin und Atorvastatin. Mit ihnen ist eine Cholesterin-Senkung um 50 Prozent des Ausgangswertes möglich.
Leitlinien
Es existieren unterschiedliche Leitlinien, die sich dem Lipidmanagement bei Fettstoffwechselstörungen widmen. Dabei werden je nach Autor beziehungsweise Land unterschiedliche Zielvorgaben gemacht. Während die aktualisierten Leitlinien der Europäischen Kardiologischen Gesellschaft (European Society of Cardiology, ESC) risikoadaptierte LDL-Zielwerte definieren, legen beispielsweise die aktuellen Leitlinien der US-Kardiologen (American College of Cardiology (ACC) und die American Heart Association (AHA)) das ermittelte kardiovaskuläre Risiko unabhängig vom LDL-Wert ihren Behandlungsstrategien zugrunde.
Demnach sollen alle Erwachsene, die ein statistisches Risiko von mehr als 7,5 Prozent haben, in den nächsten zehn Jahren einen Schlaganfall oder Herzinfarkt zu bekommen, mit Statinen behandelt werden – auch wenn ihr Cholesterinwert niedrig ist.
Neben- und Wechselwirkungen Gelegentlich werden Statine nicht vertragen. Bei einem kleinen Teil der Patienten erhöhen sich unter einer Statintherapie die Leberwerte, weshalb regelmäßige Kontrollen der Transaminasen notwendig sind. Sind diese längerfristig erhöht, müssen die Statine abgesetzt werden. Eine weitere unerwünschte Wirkung sind Muskelschmerzen (Myopathien), die meistens symmetrisch am Oberschenkel oder Schultergürtel auftreten. Eine gefürchtete, aber sehr seltene Form ist die Rhabdomyolyse, bei der es zur Auflösung von quergestreiften Muskelfasern kommen kann.
Bei Beschwerden der Muskulatur kann durch Bestimmung der Creatinkinase (CK) die Diagnose einer Myopathie bestätigt beziehungsweise über die Höhe des CK-Werts der Schweregrad bestimmt werden. Unter Umständen wird das Statin wieder abgesetzt oder in der Dosis reduziert. Zudem sind bei den Statinen mögliche Wechselwirkungen zu beachten, wobei diese je nach Statin verschieden oder unterschiedlich ausgeprägt sein können. Fast alle Statine (außer Pravastatin) werden über Enzyme der Cytochrom-P-450-Familie (CYP) abgebaut. Ein hohes Interaktionspotential besteht beispielsweise mit Simvastatin, Lovastatin und Atorvastatin.
Sie werden über das Isoenzym CYP3A4 verstoffwechselt, einem CYP-Enzym, das auch andere häufig eingesetzte Substanzen (z. B. Makrolide, Calcium-Antagonisten, Benzodiazepine, Johanniskraut, Grapefruitsaft) metabolisiert. Daher erfordert beispielsweise die gleichzeitige Einnahme mit Verapamil oder Amlodipin eine Dosisanpassung des Statins, da dessen Plasmaspiegel in Kombination mit den Calcium-Antagonisten ansteigen und damit das Risiko einer Myopathie und Rhabdomyolyse erhöhen.
Werden Makrolidantibiotika wie Erythromycin, Clarithromycin oder Telithromycin verordnet, ist das Risiko für die Muskelschädigungen derart erhöht, dass eine gleichzeitige Anwendung kontraindiziert ist und das Statin während der Behandlung ausgesetzt werden muss. Ebenso müssen bei einigen Statinen die Blutgerinnungsparameter kontrolliert werden, da sie bei gleichzeitiger Gabe mit Vitamin-K-Antagonisten wie Phenprocoumon oder Warfarin die Wirksamkeit der oralen Antikoagulanzien verstärken. Vorsicht ist hier wieder bei Simvastatin, Lovastatin und Atorvastatin geboten, aber auch Fluvastatin, Rosuvastatin und Pitavastatin verstärken die Blutungsneigung.
Einnahmetipps Prinzipiell empfiehlt sich die abendliche Einnahme der Statine. Da nachts aufgrund der hohen Aktivität der HMG-CoA-Reduktase am meisten Cholesterin produziert wird, wirken die Statine dann am besten. Nur Atorvastatin und Rosuvastatin können aufgrund ihrer höheren Halbwertszeit auch zu anderen Tageszeiten genommen werden. Die Einnahme der Statine kann unabhängig von den Mahlzeiten erfolgen.
Ausnahme ist Lovastatin, dessen Adsorption durch die gleichzeitige Nahrungsaufnahme verbessert werden kann. Eine ergänzende Einnahme von Coenzym Q10 kann sinnvoll sein. Da die HMG-CoA-Reduktase auch für die Produktion des körpereigenen Coenzyms zuständig ist, sinken unter Statineinnahme dessen Serumspiegel. Da Patienten mit Myopathie einen Coenzym Q10- Mangel aufweisen, vermutet man, dass Muskelschmerzen unter einer Statintherapie mit einer Coenzym Q10-Substitution vorgebeugt werden kann.
Weitere Therapieoptionen Wenn unter Monotherapie mit einem Statin der angestrebte LDL-Zielwert nicht erreicht wird, ist der nächste Schritt die Kombination eines Statins mit Ezetimib, dem einzigen Vertreter der Cholesterin-Resorptions-Hemmer. Die Kombinationstherapie ist eine phar- makologisch sinnvolle Kombination, die zu einer additiven Senkung der LDL-Spiegel führt. Ezetimib blockiert die Aufnahme von Cholesterin aus dem Darm über die Inaktivierung eines Transportproteins an der Darmzelle, das als spezifischer Transporter für die Resorption von Cholesterin fungiert.
Damit wird die Aufnahme von Cholesterin aus dem Darm gesenkt, wodurch weniger Cholesterin aus der Nahrung sowie körpereigenes Cholesterin in den Blutkreislauf gelangt. Die alleinige Gabe von Ezetimib ist dann eine mögliche Alternative, wenn Statine nicht vertragen werden oder kontraindiziert sind. Reicht auch die Kombination aus Statin plus Ezetimib nicht aus, um LDL in den gewünschten Zielbereich zu bringen, kann die Gabe von PCSK9-Hemmern in Betracht gezogen werden. Die bislang sehr teure Therapieoption wird vor allem bei Patienten mit familiärer Hypercholesterinämie eingesetzt.
Hierbei handelt es sich um eine neuartige Substanzklasse, die bislang mit den humanen monoklonalen Antikörpern Evolocumab und Alirocumab im Handel ist. Diese Stoffe fangen Proteasen ab, die für den Um- und Abbau von LDL-Rezeptoren verantwortlich sind. Dadurch stehen vermehrt LDL-Rezeptoren an der Zelloberfläche für die Aufnahme von LDL-Cholesterin zur Verfügung. Verordnet werden weiterhin die Anionenaustauscherharze Colestyramin und Colesevelam, die eine hohe Affinität zu Gallensäuren besitzen. Sie binden Gallensäuren im Darm, die anschließend über die Fäzes ausgeschieden werden. Somit muss die Leber das Defizit ausgleichen, indem sie neue Gallensäuren aus Cholesterin herstellt.
Dafür verwendetes LDL-Cholesterin lässt die LDL-Spiegel im Blut sinken. Fibrate wie Etofibrat, Bezafibrat, Fenofibrat und Gemfibrozil sind nur Mittel der zweiten Wahl, da sie den Cholesterinspiegel weniger effektiv als die Statine senken. Sie können als Komedikation bei zusätzlicher Hypertriglyceridämie erwogen werden, da unter ihrer Einnahme vor allem die Triglyceridspiegel fallen. Allerdings sollten sie nicht mit einem Statin kombiniert werden, da dann das Risiko einer Rhabdomyolyse deutlich ansteigt.
Den Artikel finden Sie auch in die PTA IN DER APOTHEKE 12/18 ab Seite 34.
Gode Chlond, Apothekerin
Ungünstige Lebensgewohnheiten, bestimmte Erkrankungen oder eine genetische Veranlagung können den Fettstoffwechsel durcheinanderbringen. Folge ist eine Dyslipoproteinämie. Dabei kommt es zu einer Veränderung der Lipidfraktionen im Blutserum. Unter den verschiedenen Lipiden im Serum – volkstümlich Blutfette genannt – spielen vor allem Cholesterin und Triglyceride eine wichtige Rolle. Sind ihre Werte erhöht, liegt eine Hyperlipidämie vor. Bei zu hohen Cholesterinwerten handelt es sich um eine Hypercholesterinämie, bei zu vielen Triglyceriden um eine Hypertriglyceridämie. Häufig werden gemischte Formen mit einem Zuviel an Cholesterin und Triglyceriden im Blutserum diagnostiziert (gemischte Hyperlipidämie).
Primäre und sekundäre Hyperlipidämien Je nachdem ob eine Fettstoffwechselstörung vererbt oder erworben wurde, wird in primäre oder sekundäre Formen unterschieden. Seltener sind die genetisch bedingten, primären Hyperlipidämien, von denen die Familiäre Hypercholesterinämie (FH) die bekannteste ist. Hierbei treten familiär gehäuft bereits in jungen Jahren erhöhte Cholesterinwerte auf. Schätzungen zufolge liegt die Prävalenz der FH bei einem Fall pro 200 bis 500 Personen. Somit gibt es in Deutschland etwa 160 00 bis 400 000 Patienten mit FH. Jedoch erfolgt nur bei rund ein bis zehn Prozent der betroffenen Patienten eine Diagnosestellung.
Die Betroffenen zählen zu den Hochrisikopatienten, da sie unbehandelt ein stark erhöhtes Risiko haben, Herz-Kreislauf-Erkrankungen zu entwickeln. Liegt eine heterozygote FH (heFH) vor, bei der die Anlage von einem Elternteil mit FH vererbt wurde, besteht bei unbehandelten Männern ein 50-prozentiges Risiko für das Auftreten eines koronaren Ereignisses bis zu einem Alter von 50 Jahren. Bei Frauen mit einer unbehandelten heFH besteht ein 30-prozentiges Risiko für koronare Ereignisse bis zu einem Alter von 60 Jahren. Bei der äußerst seltenen homozygoten Familiären Hypercholesterinämie (hoFH), bei der beide Elternteile Träger von FH sind und diese Anlage vererben, liegt meist spätestens im Alter von 25 Jahren eine schwerwiegende koronare Herzerkrankung vor.
Die meisten Feststoffwechselstörungen zählen zu den sekundären Formen, die nicht vererbt wurden, sondern sich im Laufe des Lebens durch ungünstige Lebensgewohnheiten beziehungsweise zugrundeliegende Erkrankungen einstellen. So geht man davon aus, dass etwa 70 Prozent aller Hypercholesterinämien sekundär erworben sind. Sie werden durch eine falsche Ernährung (zu viel, zu fett), einen Mangel an Bewegung, die Einnahme von Medikamenten (z. B. Corticosteroide, Gestagene, Betablocker) oder Erkrankungen wie Diabetes mellitus, Nieren-, Leber- oder Schilddrüsenerkrankungen (z. B. Hypothyreose) ausgelöst.
Auch erhöhte Triglyceridwerte können genetisch oder lebensstilbedingt sein. Vor allem spielen bei den sekundär bedingten Hypertriglyceridämien Lebensstilfaktoren wie eine hyperkalorische Ernährung, die sich mit Übergewicht manifestiert, sowie ein erhöhter Alkoholkonsum eine Rolle. Erhöhte Triglyceride gehen häufig mit einer Insulinresistenz im Rahmen des metabolischen Syndroms einher, bei der die Betroffenen bewegungsarm leben, übergewichtig oder adipös sind, Bluthochdruck haben und viel viszerales Fettgewebe aufweisen.
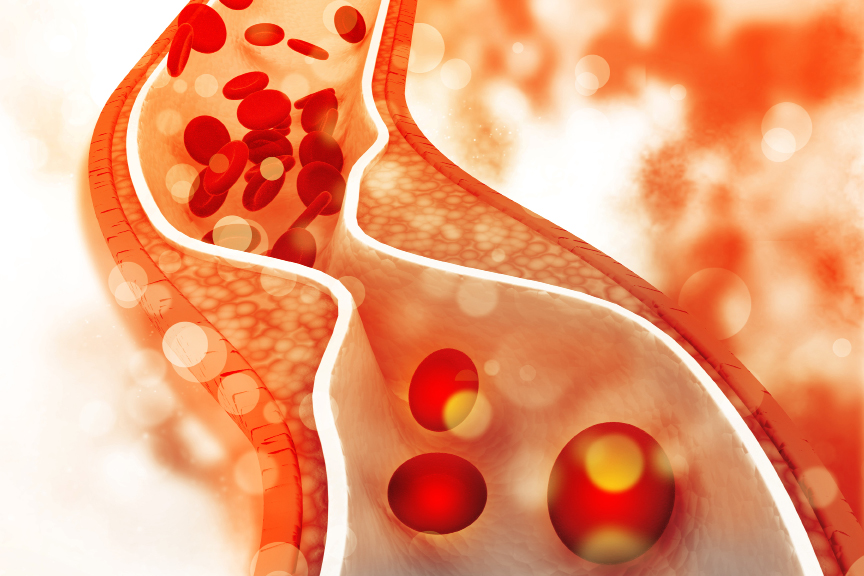
Arteriosklerotische Plaques
LDL-Lipoproteine sind entscheidend an der Entwicklung der Gefäßablagerungen beteiligt und erhöhen damit das Risiko für Herz-Kreislauf-Erkrankungen. Überschüssige LDL-Partikel wandern in die innerste Schicht der Gefäßwand ein und oxidieren zu oxLDL. Diese werden dort von Immunzellen, den Makrophagen, aufgenommen. Die mit LDL-Cholesterin beladenen Fresszellen bauen sich dann zu Schaumzellen um und schütten Botenstoffe aus, die chronische Entzündungsprozesse in Gang setzen.
Zudem werden weitere Fresszellen, aber auch glatte Muskelzellen und Bindegewebszellen angelockt. Die Folge sind Ablagerungen an den Gefäßwänden, die den Innendurchmesser der Blutgefäße immer mehr einengen und das Blut nicht mehr ungehindert fließen lassen. Auch werden die Gefäßwände dadurch zunehmend starrer und brüchiger. Gefährlich wird es, wenn die arteriosklerotischen Plaques aufbrechen. Dann bilden sich Blutgerinnsel (Thromben), die den Blutfluss behindern oder gar zum Erliegen bringen oder im Blutstrom mitgerissen werden können.
Fettstoffwechsel Lipide sind lebensnotwendig und üben im Organismus vielfältige Funktionen aus. Triglyceride sind Hauptbestandteil vieler fetthaltiger Lebensmittel. Die Leber kann solche mit gesättigten Fettsäuren auch aus Kohlenhydraten selber synthetisieren. Bei Triglyceriden sind die drei Hydroxylgruppen des Glycerins mit verschiedenen Fettsäuren verestert. Je nach Kettenlänge der gebundenen Fettsäuren wird zwischen mittel- und langkettigen Triglyceriden differenziert. Triglyceride liefern dem Körper Energie und sind in Form von Depotfett der wichtigste Energiespeicher. Auch Cholesterin ist unentbehrlich und übernimmt im Organismus zahlreiche Aufgaben.
Als Bestandteil der Zellmembranen sorgt es für die Stabilität und Funktion der Zellen. Zudem ist Cholesterin Ausgangssubstanz für die Synthese von Steroidhormonen der Nebennierenrinde (Corticoide), Sexualhormonen (Androgene, Progesteron, Estrogene), Vitamin D3 und Gallensäuren. Chemisch gesehen ist Cholesterin ein Steroidalkohol, weshalb die Bezeichnung Cholesterol korrekt ist. Verbreiteter ist aber die ältere Bezeichnung Cholesterin, vor allem bei Ihren Kunden in der Apotheke. Cholesterin ist ein lipophiler Stoff, der in allen Zellen des menschlichen Körpers vorkommt. Der höchste Gehalt befindet sich in der Nebennierenrinde, im Gehirn und in der Galle.
Den größten Teil (circa 700 bis 900 mg) stellt der Körper selber her, vor allem geschieht dies in der Leber. Von dort aus wird es in den Blutkreislauf und somit in die Gewebe abgegeben, wo es verstoffwechselt wird. Zusätzlich gelangen geringe Mengen aus der Nahrung tierischen Ursprungs (z. B. Fleisch, Wurstwaren, Eier, Milchprodukte) in den Organismus und werden über die Lymphe in den Blutkreislauf und so dem Stoffwechsel zugeführt. Beim gesunden Menschen sorgen Regelmechanismen im Körper für einen gleichbleibenden Cholesterinspiegel im Blut.
Wird vermehrt Cholesterin mit der Nahrung zugeführt, drosselt der Organismus die körpereigene Produktion und umgekehrt. Cholesterin, das der Körper nicht verwerten kann, lagert sich teilweise an den Gefäßwänden ab und trägt zur Bildung arteriosklerotischer Plaques bei. Überschüssiges Cholesterin wird aber auch zur Leber zurücktransportiert, wo es unter anderem zu Gallensäuren verarbeitet wird, die wiederum mit der Gallenflüssigkeit in den Darm für die Fettverdauung gelangen.
Lipoproteine als Transportsystem Da Lipide prinzipiell nicht wasserlöslich sind, werden sie für ihren Transport im Blut an Proteine gebunden. Zusammen bilden sie kugelförmige Partikel, die Lipoproteine. Diese speziellen Fett-Eiweiß-Gebilde werden entsprechend ihrer Dichte in verschiedene Klassen unterteilt. Je größer der Anteil an Lipiden ist, desto geringer ist die Dichte. Man unterscheidet Chylomikronen, Very Low Density Lipoproteine (VLDL), Low Densitiy Lipoproteine (LDL) und High Density Lipoproteine (HDL). Chylomikronen werden im Darm gebildet und transportieren zugeführte Nahrungsfette über die Lymphe und die Blutbahn zur Leber.
Sie sind durch einen sehr hohen Lipid- und geringen Proteingehalt gekennzeichnet. Überwiegend enthalten sie Triglyceride, daneben auch geringe Mengen an Cholesterin. Auf ihrem Weg zur Leber geben sie Triglyceride und freie Fettsäuren an die Gewebe ab. Die Reste (Remnants), die noch viel Cholesterin enthalten, werden von der Leber wiederaufgenommen und abgebaut. Übrig gebliebene Triglyceride werden in der Leber zu VLDL, Lipoproteinen besonders niedriger Dichte, verpackt und in den Blutstrom zu den Muskel- und Fettzellen entsendet. VLDL enthalten fünfmal mehr Triglyceride als Cholesterin. Im Blutplasma schrumpfen sie allmählich durch Abspaltung der Triglyceride und gehen in cholesterinreiche LDL über.
Die Lipoproteine niedriger Dichte, also die LDL, haben von allen Lipoproteinen den höchsten Cholesteringehalt und transportieren ungefähr 80 Prozent des gesamten Plasmacholesterins. Sie befördern es zu den Organen, wo es über spezielle LDL-Rezeptoren in die Zellen eingeschleust und verstoffwechselt wird. Ist das Cholesterinangebot größer als die Aufnahmekapazität, verbleibt LDL im Blut und kann in das Gefäßendothel, das heißt in die innerste Wandschicht der Blutgefäße eindringen und arteriosklerotische Prozesse in Gang setzten. Da LDL-Cholesterin entscheidend an der Ausbildung einer Arteriosklerose beteiligt ist und damit das Risiko für Herz-Kreislauferkrankungen erhöht, wird es im Volksmund auch als „schlechtes“ Cholesterin bezeichnet.
Lipoproteine hoher Dichte, HDL, gelten hingegen als „gutes“ Cholesterin. HDL werden überwiegend im Darm, aber auch in der Leber und im Blut bei der Verstoffwechselung anderer Lipoproteine gebildet. Sie befördern hauptsächlich überschüssiges Cholesterin aus den Zellen zur Leber zurück, wo es zu Gallensäuren umgewandelt und über den Darm ausgeschieden wird. Zudem sind sie in der Lage, selbst bereits an Gefäßwände gebundenes Cholesterin wieder herauszulösen und abzutransportieren.
Gefahr des Gefäßverschlusses Je nach Ort des Geschehens führen die Gefäßveränderungen entweder zu Durchblutungsstörungen in den Beinarterien, in den Herzkranzgefäßen oder in den Hirnarterien. Eine mangelnde Durchblutung im Bereich der Beine löst starke Schmerzen beim Laufen aus, was als Claudicatio intermittens oder volkstümlich Schaufensterkrankheit bekannt ist. Kommt es zu einem vollständigen Gefäßverschluss spricht man von der peripheren arteriellen Verschlusskrankheit (pAVK).
Gefäßveränderungen in den Herzkranzgefäßen führen zur koronaren Herzkrankheit (KHK), die sich unterschiedlich manifestieren kann. Eine Mangeldurchblutung, die sich mit Brustenge bemerkbar macht, wird als Angina pectoris bezeichnet. Reißt eine abgelagerte Plaque ein und setzt einen Thrombus frei, kann er das Gefäß schlagartig verschließen, was sich bei einem Verschluss in den Herzkranzgefäßen als Herzinfarkt äußert. Zu einem Schlaganfall kommt es, wenn sich die gefäßverengenden Vorgänge in einem hirnversorgenden Gefäß abspielen.
Atherogenes Lipoprotein(a)
Zu den wichtigsten Risikofaktoren einer Arteriosklerose zählt neben LDL-Cholesterin auch das Lipoprotein(a). Ähnlich dem LDL handelt es sich bei dem Lipoprotein(a) um ein cholesterinreiches Lipoprotein. Es ist durch das zusätzliche Eiweiß Apolipoprotein(a) gekennzeichnet und ist wie das LDL-Cholesterin bei zu hohen Konzentrationen im Plasma Ursache für arteriosklerotische Prozesse. Die Konzentration von Lipoprotein(a) im Blut ist weitgehend erblich bedingt. Erhöhte Lipoprotein(a)-Werte gelten als ein eigenständiger Risikofaktor für die Herz-Kreislauf-Gesundheit.
Liegen noch weitere Risikofaktoren wie Diabetes mellitus, hohes LDL-Cholesterin, hohe Triglyceride, bauchbetontes Übergewicht, Bluthochdruck und/oder Rauchen vor, ist ein Mensch besonders gefährdet, einen Herzinfarkt oder einen Schlaganfall zu erleiden. Bei etwa jedem fünften Erwachsenen liegen die Lipoprotein(a)-Werte über 50 mg/dl, was als riskant gilt. Derzeit ist es nicht möglich, erhöhte Lp(a)- Konzentrationen medikamentös zu senken. Unter der Therapie mit Cholesterinsenkern verändert sich der Lipoprotein(a)-Wert nicht. Deshalb ist es wichtig, das Gesamtrisikoprofil zu verbessern und anderen Risikofaktoren für eine Arteriosklerose vorzubeugen.
Folge erhöhter Triglyceridwerte Aber auch zu hohe Triglyceridwerte haben Folgen für den Organismus. Während eine Hypercholesterinämie als Risikofaktor für die KHK als gesichert gilt, ist der Zusammenhang zwischen erhöhten Triglyceridkonzentrationen und der Entstehung einer Arteriosklerose schwer belegbar. Dennoch geht man davon aus, dass auch eine Hypertriglyceridämie zu Gefäßschädigungen und damit zu Herz-Kreislauf-Erkrankungen beitragen kann.
Zudem gilt sie als ein Risikomarker, da sie in den meisten Fällen mit weiteren arteriosklerotischen Risikofaktoren wie Übergewicht, Bluthochdruck oder Diabetes mellitus vergesellschaftet ist. Unabhängig von einem möglichen Arterioskleroserisiko besteht bei stark erhöhten Triglyceridwerten die Gefahr für Mikrozirkulationsstörungen und akute Bauchspeicheldrüsenentzündungen (Pankreatitiden).
Lipidwerte bestimmen Das Fatale ist, dass erhöhte Cholesterin- und Triglyceridwerte im Blut lange Zeit keinerlei Beschwerden verursachen. Arteriosklerotische Prozesse entwickeln sich über viele Jahre hinweg und ihre Auswirkungen werden häufig erst sichtbar, wenn sich Komplikationen einstellen. Um Spätfolgen zu vermeiden, sollten daher regelmäßig (circa einmal jährlich) die Blutfette gemessen werden. Dabei sollte nicht nur eine Messung des Gesamt-Cholesterins, sondern auch der einzelnen Lipidfraktionen, also Triglyceride, HDL und LDL, erfolgen.
Zusätzlich ist es sinnvoll, Lipoprotein(a), ein Fett-Transportprotein, kontrollieren zu lassen. Da dieser Wert genetisch bedingt ist und im Verlauf des Lebens gleichbleibt, muss er nur einmal bestimmt werden. Es wird empfohlen, die Bestimmung der Lipidparameter möglichst nüchtern (zwölf Stunden nach der letzten Mahlzeit) durchzuführen, da die Triglyceridewerte nach einer Mahlzeit ansteigen. Die Cholesterinkonzentrationen im Blut werden in Milligramm pro Deziliter (mg/dl) oder Millimol pro Liter (mmol/l) angegeben.
Gesamtrisiko entscheidend Während man früher hinsichtlich des individuellen Risikos für Herz-Kreislauf-Erkrankungen dem Gesamt-Cholesterinwert eine hohe Bedeutung zugemessen und Werte über 200 mg/dl als grundsätzlich behandlungsbedürftig gesehen hat, dient der Gesamt-Cholesterinwert inzwischen lediglich der Orientierung. Werte über 200 mg/dl müssen in der Regel nicht Anlass sein, eine Therapie einzuleiten, sollten aber dazu auffordern, die einzelnen Blutfettwerte näher zu bestimmen. Andererseits existieren auch Fettstoffwechselstörungen, die mit einem Gesamtcholesterin unter 200 mg/dl einhergehen, aber dennoch mit einem erhöhten Arterioskleroserisiko verbunden sind, wenn dabei das HDL-Cholesterin unter 40 mg/dl liegt.
Heute liegt der Fokus vor allem auf dem LDL-Wert, da dauerhaft hohe LDL-Cholesterinwerte als Risikofaktor für die koronare Herzerkrankung an erster Stelle stehen. Dabei wird ein individueller LDL-Zielwert festgelegt, der weitere kardiovaskuläre Risikofaktoren berücksichtigt (risikoadaptierter LDL-Zielwert). Erst aus der Summe aller Befunde – aus dem Gesamtrisiko – lässt sich der anzustrebende LDL-Zielwert und damit eine eventuelle Behandlungsnotwendigkeit ableiten. Das individuelle Risiko bestimmt also den Therapiebedarf.
LDL-Cholesterin Zielwerte Die Entstehung arteriosklerotischer Gefäßerkrankungen ist also in der Regel das Ergebnis mehrerer vorliegender Risikofaktoren. Ein erhöhter LDL-Wert ist nur ein kardiovaskulärer Risikofaktor von vielen. Das Risiko erhöht sich durch weitere Größen, wobei häufig mehrere gleichzeitig auftreten. Dazu zählen beispielsweise Diabetes mellitus, Bluthochdruck, bauchbetontes Übergewicht, Bewegungsmangel, Rauchen und/oder Stress. Zudem sind dies mittel- bis hochgradige Niereninsuffizienz, eine Erhöhung von Lipoprotein(a), ein HDL-Wert unter 40 mg/dl, eine familiäre Veranlagung sowie das Alter (> 45 Jahre für Männer, > 55 Jahre für Frauen).
Praktisch bedeutet das, dass der Arzt für seine Therapieentscheidung zuerst einmal alle Risikofaktoren des Patienten ermittelt und danach ein individuelles kardiovaskuläres Risiko bestimmt. Je nachdem wie hoch er das Risiko seines Patienten für die Entwicklung einer Herz-Kreislauf-Erkrankung einschätzt (sehr hoch, hoch, moderat oder niedrig), legt er darauf abgestimmt einen individuellen LDL-Zielwert fest. Als Faustregel gilt, je mehr Risikofaktoren vorliegen beziehungsweise je höher das individuelle kardiovaskuläre Risiko ist, desto niedriger sollte der angestrebte LDL-Zielwert sein.











