Sanofi-Aventis GmbH | Markteinführung
VERORAB® LÖST TOLLWUT-IMPFSTOFF (HDC), INAKTIVIERT AB
Seite 1/1 7 Minuten
Der Hauptunterschied zwischen Tollwut-Impfstoff (HDC) inaktiviert und Verorab® besteht im Herstellungsverfahren: Tollwut-Impfstoff (HDC) inaktiviert wird in humanen diploiden Zellen (HDC) hergestellt, Verorab® dagegen in Vero-Zellen. Sanofi kann so produzieren, dass eine Versorgung mit Verorab® in allen Ländern kontinuierlich und schnell möglich ist, um die Versorgung zur Immunisierung gegen Tollwut sicherzustellen.
Heidrun Irschik-Hadjieff General Manager Vaccines bei Sanofi, Deutschland und Österreich „Global fallen der Tollwut weiterhin viele tausend Menschen jährlich zum Opfer. In Westeuropa stellt sie vor allem für Reisende eine Gefahr dar. Sanofi engagiert sich seit fast 50 Jahren im Kampf gegen Tollwut. Daher stellen wir nach der erfolgreichen Zulassung von Verorab® in Deutschland von Tollwut-Impfstoff (HDC) inaktiviert auf Verorab® um.“
Tollwut
Die übertragbare Viruserkrankung Tollwut existiert immer noch in über 150 Ländern weltweit.1 Geschätzt 59 000 Menschen sterben jährlich an Tollwut.1-3 Tollwut verläuft fast immer tödlich, ist aber durch Impfungen nahezu zu 100 Prozent vermeidbar.4
99 Prozent der Fälle werden durch Hundebisse übertragen (der Rest über Wildtiere wie z. B. Füchse, Waschbären).5 Kinder haben das größte Risiko, da sie häufiger mit Tieren spielen und häufiger gekratzt oder gebissen werden.5,6
40 Prozent der Personen, die von Tieren mit Verdacht auf Tollwut gebissen werden, sind unter 15 Jahre alt.5 Das Risiko einer Tollwutexposition steigt erheblich bei Reisen in endemische Regionen (z. B. Regionen in Asien oder Afrika).1,4 Pro Aufenthaltsmonat in einer Region, in der die Tollwut endemisch ist, erleiden 4 von 1000 Reisenden einen Biss mit Tollwutrisiko.4,6
Klinische Studien: Immunantwort mit Tollwutvirus-neutralisierenden Antikörpertitern7
Um die Immunogenität von Verorab® bei der präexpositionellen und postexpositionellen Prophylaxe zu untersuchen, wurden klinische Studien durchgeführt. Dabei wurde ein Tollwutvirus-neutralisierender Antikörpertiter von ≥ 0,5 I.E./ml von der WHO (World Health Organization), als schützend angesehen.
Präexpositionelle Prophylaxe (PrEP)7 In klinischen Studien zur Beurteilung der Effektivität eines 3-Dosen-Impfschemas (T0, T7, T28 [oder T21]) bei Erwachsenen und Kindern erreichten alle Patient*innen eine ausreichende Immunantwort mit Tollwutvirus-neutralisierenden Antikörpertitern von ≥ 0,5 I. E./ml bis T14 nach dem Ende der Grundimmunisierung. Eine zehnjährige Nachbeobachtung bei 49 Patient*innen, die ein 3-Dosen-Schema (T0, T7 und T28), gefolgt von einer Auffrischimpfung ein Jahr später, erhielten, zeigte eine persistierende Immunantwort mit Tollwutvirus-neutralisierenden Antikörpertitern von ≥ 0,5 I. E./ml bis zu 10 Jahre bei 96,9 % der geimpften Patient*innen.
Postexpositionelle Prophylaxe (PEP)7 In klinischen Studien zur Beurteilung des Essen-Impfschemas (5 intramuskuläre Dosen an T0, T3, T7, T14 und T28) und des Zagreb-Impfschemas (2 intramuskuläre Dosen an T0, danach 1 Dosis an T7 und 1 Dosis an T21) bei Kindern und bei Erwachsenen erzielte Verorab® einen Tollwutvirus-neutralisierenden Antikörpertiter von ≥ 0,5 I. E./ml bei fast allen geimpften Patient*innen an T14 und bei allen geimpften Patient*innen an T28.
Während einer Phase-3-Studie mit 600 exponierten Patient*innen im Alter von 11 Monaten bis 50 Jahren wurden zwei intradermale Impfschemata zur postexpositionellen Prophylaxe getestet. Fast alle geimpften Personen (98,8 %) erreichten an T14 einen Tollwutvirus-neutralisierenden Antikörpertiter von ≥ 0,5 I. E./ml.
Fünf Jahre später und vor Erhalt der simulierten PEP war der schützende Titer der Tollwutvirus-neutralisierenden Antikörper bei mehr als 84,0 % bzw. bei 64,1 % der Patient*innen erhalten. Die Wirksamkeit von Verorab® wurde in einer Phase-4-Studie bei 44 erwachsenen Patient*innen untersucht, die von nachweislich mit Tollwut infizierten Tieren gebissen worden sind. Die Patient*innen erhielten den Impfstoff gemäß dem 5-Dosen-Essen-Impfschema und bei Bedarf Immunglobuline. Alle Patient*innen waren drei Jahre nach der postexpositionellen Prophylaxe am Leben.
Über Verorab®
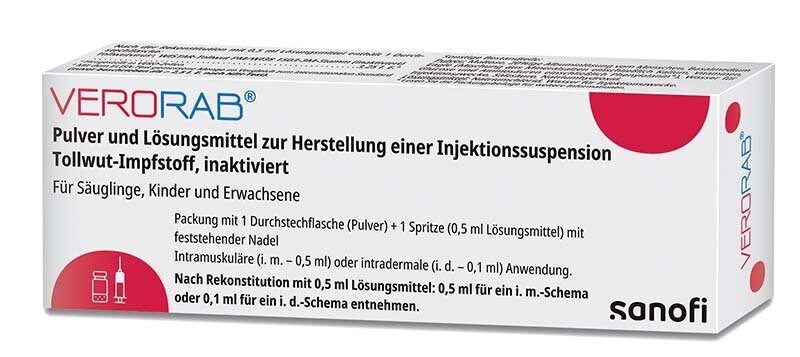
Der Impfstoff Verorab® Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension Tollwut-Impfstoff, inaktiviert ist in Deutschland zur präexpositionellen und postexpositionellen Prophylaxe gegen Tollwut bei Personen aller Altersgruppen zugelassen.7 Verorab® kann als Auffrischimpfung nach einer Grundimmunisierung mit einem in einer Zellkultur hergestellten Tollwut-Impfstoff angewendet werden (ein in VERO-Zellen oder humanen diploiden Zellen [HDCV] hergestellter Tollwut-Impfstoff).
Tollwut-Impfstoff (HDC) inaktiviert und Verorab® haben ein ähnliches Wirksamkeits- und Sicherheitsprofil, das durch klinische Studien und Jahrzehnte weltweiter Anwendung belegt ist. Die präexpositionelle Grundimmunisierung besteht aus drei Dosen zu je 0,5 ml Verorab®, die an den Tagen (T) T0, T7 und T28 (oder T21) intramuskulär verabreicht werden. Der Impfstoff Verorab® wird ausschließlich in Frankreich hergestellt, was mehr Unabhängigkeit und Stabilität in der Lieferkette ermöglicht. Wie alle Impfstoffe von Sanofi wird Verorab® in einer modernen Produktionseinrichtung produziert.8
Referenzen:
1 World Health Organization (WHO). Epidemiology and burden of disease. Rabies. Verfügbar unter: https://www.who.int/teams/control-of-neglected-tropical-diseases/rabies/epidemiologyand-burden. Zuletzt aufgerufen: Dezember 2023.
2 Centers for Disease Control and Prevention (CDC). Pressemitteilung “Every 9 minutes, someone in the world dies of rabies”. 2015. Verfügbar unter: https://archive.cdc.gov/www_cdc_gov/ media/releases/2015/p0928-rabies.html. Zuletzt aufgerufen: Dezember 2023.
3 World Organisation for Animal Health (WOAH). Rabies. 2023. Verfügbar unter: https://www.woah.org/en/disease/rabies. Zuletzt aufgerufen: Dezember 2023.
4 Steffen R, et al. Travel vaccine preventable diseases—updated logarithmic scale with monthly incidence rates. J. Travel Med. 2018; 25(1):tay046.
5 World Health Organization (WHO). Rabies. Key facts. 2023. Verfügbar unter: https://www.who.int/news-room/fact-sheets/detail/rabies. Zuletzt aufgerufen: Dezember 2023.
6 Gautret P and Parola P. Rabies vaccination for international travelers. Vaccine. 2012; 30(2):126- 133.
7 Fachinformation Verorab®. Aktueller Stand.
8 Sanofi Pasteur. Making vaccines for good public health. 2022. Verfügbar unter: https://www.sanofi.com/en/your-health/vaccines/production. Zuletzt aufgerufen: Dezember 2023.
Verorab® Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension. Tollwut- Impfstoff, inaktiviert. Wirkstoffe/Qualitative und quantitative Zusammensetzung: 1 Dosis (0,5 ml) des rekonstituierten Impfstoffs enthält: 3,25 I.E.* Tollwutviren**, WISTAR-Tollwut-PM/WI38 1503-3M-Stamm (inaktiviert). *Menge gemessen mit dem ELISA-Test gegen den internationalen Standard. **Hergestellt in VERO-Zellen. Liste der sonstigen Bestandteile: Pulver (Zusammensetzung vor dem Gefriertrocknungsschritt): Maltose, 20%ige Albuminlösung vom Menschen, Basalmedium Eagle: Mischung aus Mineralsalzen (einschließlich Kalium), Vitaminen, Glucose und Aminosäuren (einschließlich Phenylalanin), Salzsäure und Natriumhydroxid zur Einstellung des pH-Wertes, Wasser für Injektionszwecke, Lösungsmittel: Natriumchlorid, Wasser für Injektionszwecke. Anwendungsgebiete: Indiziert zur präexpositionellen und postexpositionellen Prophylaxe gegen Tollwut in allen Altersgruppen. Anwendung entsprechend den offiziellen Empfehlungen. Gegenanzeigen: Impfung nach Tollwutexposition: Keine. Vorbeugende Impfung: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile, gegen Polymyxin B, gegen Streptomycin, gegen Neomycin oder ein Antibiotikum derselben Klasse bei einer früheren Verabreichung oder gegen einen Impfstoff, der die gleichen Bestandteile enthält. Bei Fieber oder akuter Erkrankung Impfung verschieben. Nicht intravasal verabreichen. Nicht in die Gesäßregion injizieren. Nebenwirkungen: Aus Studien und weltweiten Meldungen nach Markteinführung bei - Kindern und Jugendlichen < 18 Jahren: Blut und Lymphsyst.: Häufig: Lymphadenopathie. Immunsyst.: Gelegentl.: Allergische Reaktionen (z. B. Ausschlag, Urtikaria, Pruritus); Nicht bek.: Anaphylaktische Reaktion und Angioödem. Stoffwechsel- und Ernährungsstör.: Häufig: Verminderter Appetit. Nerven: Sehr häufig: Kopfschmerzen; Reizbarkeit (bei Säuglingen/Kleinkindern), Somnolenz (bei Säuglingen/Kleinkindern); Häufig: Schlaflosigkeit (bei Säuglingen/Kleinkindern). Ohr und Labyrinth: Nicht bek.: Hörsturz, der andauern kann. GIT: Gelegentl.: Abdominalschmerz, Erbrechen. Skelettmskl, Bindegew., Knochen: Sehr häufig: Myalgie. Allg. Erkrankungen/Beschwerden am Verabreichungsort: Sehr häufig: Schmerzen a. d. Injektionsst. (i. m. und i. d.), Erythem a. d. Injektionsst. (i. d), Schwellung a. d. Injektionsst. (i. d.), Unwohlsein, Untröstliches Weinen (bei Säuglingen/Kleinkindern); Häufig: Erythem a. d. Injektionsst. (i. m.), Schwellung a. d. Injektionsst. (i. m.), Fieber; Gelegentl.: Jucken a. d. Injektionsst. (i. d.), Schüttelfrost. - Erwachsenen ≥ 18 Jahren: Blut und Lymphsyst.: Häufig: Lymphadenopathie. Immunsyst.: Gelegentl.: Allergische Reaktionen (z. B. Ausschlag, Urtikaria, Pruritus); Nicht bek.: Anaphylaktische Reaktion und Angioödem. Stoffwechsel- und Ernährungsstör.: Gelegentl.: Verminderter Appetit. Nerven: Sehr häufig: Kopfschmerzen; Gelegentl.: Schwindelgefühl/Vertigo. Ohr und Labyrinth: Nicht bek.: Hörsturz, der andauern kann. Atemwege, Brustraum und Mediastinum: Selten: Dyspnoe. GIT: Gelegentl.: Übelkeit, Abdominalschmerz, Diarrhö. Skelettmskl, Bindegew., Knochen: Sehr häufig: Myalgie; Gelegentl.: Arthralgie. Allg. Erkrankungen/Beschwerden am Verabreichungsort: Sehr häufig: Schmerzen a. d. Injektionsst. (i. m. und i. d.), Erythem a. d. Injektionsst. (i. d.), Unwohlsein; Häufig: Erythem a. d. Injektionsst. (i. m.), Jucken a. d. Injektionsst. (i. m. und i. d.), Schwellung a. d. Injektionsst. (i. m. und i. d.), Verhärtung a. d. Injektionsst. (i. m.), Influenzaartiges Syndrom, Fieber; Gelegentl.: Injektionsstelle Hämatom (i. d.), Asthenie, Schüttelfrost. Die Verschlusskappen der Spritzen ohne feststehende Nadel enthalten ein Naturkautschuk-Latexderivat. Abgabe/Verschreibungspflicht: Deutschland: Verschreibungspflichtig. Österreich: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Pharmakotherapeutische Gruppe: Tollwut-Impfstoffe, ATC-Code: J07BG01. Pharmazeutischer Unternehmer/Zulassungsinhaber: Sanofi Pasteur Europe, 14 Espace Henry Vallée, 69007 Lyon, Frankreich. Örtlicher Vertreter d. Zulassungsinhabers: Sanofi-Aventis Deutschland GmbH, 65926 Frankfurt am Main, Deutschland. sanofi-aventis GmbH, 1100 Wien, Österreich. Stand der Information: Mai 2023 Weitere Angaben zu den besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen, Fertilität, Schwangerschaft und Stillzeit, Nebenwirkungen sowie ggf. Gewöhnungseffekten sind der veröffentlichten Fachinformation zu entnehmen.