Diabetes mellitus
KRANKHAFT ERHÖHTE BLUTZUCKERSPIEGEL
Seite 1/1 11 Minuten
In Deutschland sind Schätzungen zufolge mindestens acht Millionen Menschen an Diabetes mellitus erkrankt und etwa 175 000 Betroffene im Jahr 2010 aufgrund ihrer Stoffwechselerkrankung und deren Folgen gestorben. Das entspricht etwa jedem fünften Todesfall. Generell ist die Lebenserwartung eines Diabetikers im Durchschnitt um etwa fünf bis sechs Jahre kürzer als die gleichaltriger Personen ohne Zuckerkrankheit. Das alles sind erschreckende Zahlen. Häufig wird die Gefährlichkeit von Diabetes allerdings unterschätzt, zumal sich die Krankheit schleichend und lange unbemerkt entwickelt. Ein Blick auf die Ursachen und Folgen der Stoffwechselentgleisung zeigt, warum Diabetes eine lebensbedrohliche Erkrankung darstellt.
Insulin im Fokus Prinzipiell gibt es nicht nur den einen Diabetes. Unter dem Begriff Diabetes mellitus wird vielmehr eine Gruppe von Stoffwechselerkrankungen zusammengefasst, die durch einen krankhaft erhöhten Blutzuckerspiegel gekennzeichnet sind. Auslöser sind Defekte bei der Insulinausschüttung, eine gestörte Insulinwirkung oder eine Kombination aus beidem. Der Organismus benötigt für die Zuckerverwertung das Hormon Insulin. Ohne Insulin kann er die Glucose aus dem Blut nicht in die Körperzellen aufnehmen – der Glucosespiegel im Blut steigt folglich an. Je nach Ursache, klinischem Erscheinungsbild und erforderlicher Behandlungsstrategie werden verschiedene Diabetes-Typen unterschieden, wobei die zwei häufigsten Formen der Diabetes vom Typ 1 und Typ 2 sind. Während aber beim Typ 1 entweder kaum oder gar kein Insulin gebildet wird, beruht der Typ 2 auf einer verminderten Ansprechbarkeit der Zellen auf Insulin.
Venen- und Kapillarblut
Zu beachten ist, dass die Werte, die beim Arzt aus dem venösen Plasma bestimmt werden, anders ausfallen können als die, die der Patient zu Hause aus dem kapillären Vollblut gemessen hat. Im Plasma liegen die Werte höher (etwa 10 bis 15 Prozent) als im Vollblut. Ein Plasma-Glucosewert von 125 mg/dl (7,0 mmol/l) entspricht einem Kapillarblut-Glucosewert von 110 mg/dl (6,1 mmol/l). Moderne Geräte zur Selbstkontrolle aus Kapillarblut sind heute aber meist auf Plasma geeicht und zeigen dann vergleichbare Werte an.
Diabetes Typ 1 Früher wurde dieser Typus als jugendlicher (juveniler) Diabetes bezeichnet, da er häufig bereits bei Jugendlichen und jungen Erwachsenen diagnostiziert wird. Heute ist dieser Begriff nicht mehr üblich, denn die Krankheit kann sich auch noch im höheren Lebensalter zum ersten Mal manifestieren. Außerdem tritt immer häufiger auch der Typ 2 in jungen Jahren auf. Der Diabetes Typ 1 ist eine Autoimmunkrankheit, die bei genetisch disponierten Personen eine progressive Selbstzerstörung der insulinproduzierenden Betazellen in der Bauchspeicheldrüse auslöst. Folge ist anfangs ein relativer, später ein totaler Insulinmangel, der eine lebenslange Insulinsubstitution erforderlich macht.
Darauf bezieht sich auch die ältere Bezeichnung insulinpflichtiger Diabetes. Aber auch dieser Begriff wird nicht mehr verwendet, da eine Insulingabe ebenso für andere Diabetesformen obligatorisch werden kann. Sind mehr als 80 bis 90 Prozent der Betazellen vernichtet, stellen sich die typischen Diabetes-Symptome schlagartig ein. Dazu gehören vermehrter Durst (tägliche Aufnahme mehrerer Liter Flüssigkeit), häufiges Wasserlassen (auch in der Nacht), Gewichtsabnahme trotz Heißhunger, Müdigkeit, Absinken der Konzentrationsfähigkeit und Nachlassen der körperlichen Leistungskraft. Der verstärkte Abbau von Fettsäuren führt zu einem Anstieg von Ketonkörpern im Blut, was eine Übersäuerung des Blutes (Ketoazidose) bedingt.
Zudem kommt es zu einem Acetongeruch der Atemluft sowie Bauchschmerzen, Übelkeit und Erbrechen. Unbehandelt kann sich ein lebensgefährliches diabetisches Koma entwickeln, das die unverzügliche Aufnahme ins Krankenhaus erforderlich macht. Typischerweise erfolgt die Diagnose Diabetes Typ 1 häufig aufgrund einer ketoazidotischen Stoffwechselentgleisung.
Diabetes Typ 2 Die meisten Diabetiker – etwa 90 Prozent – leiden heute an einem Diabetes Typ 2. Hier verlaufen die Stoffwechselentgleisungen zu Anfang in der Regel nahezu unbemerkt, sodass ein erhöhter Blutzuckerspiegel schon jahrelang im Verborgenen vorhanden sein kann, bevor dieser Typus vom Arzt diagnostiziert wird. Symptome wie Müdigkeit, verstärktes Durstgefühl oder vermehrtes Wasserlassen sind sehr unspezifisch und beim Diabetes Typ 2 zudem nicht immer vorhanden oder werden von den Betroffenen nicht zwangsläufig mit einem sich manifestierenden Diabetes in Verbindung gebracht. Die Diagnose Diabetes Typ 2 ist häufig ein Zufallsbefund, der bei Routineuntersuchungen entdeckt wird.
Früher wurde von einem Altersdiabetes gesprochen, da die überwiegende Zahl der Betroffenen älter als 60 Jahre ist. Da aber zunehmend jüngere Menschen, sogar Kinder und Jugendliche, erkranken, wird der Begriff inzwischen auch nicht mehr gebraucht. Während der Diabetiker vom Typ 1 in der Regel normalgewichtig ist, tritt der Diabetes Typ 2 zumeist bei übergewichtigen Personen auf, schlanke Menschen sind weitaus seltener betroffen. Grundsätzlich wird die Anlage zum Diabetes Typ 2 vererbt. Risikofaktoren begünstigen die Krankheitsentstehung, wobei Übergewicht in Verbindung mit Bewegungsmangel eine entscheidende Rolle spielt.
Viszerales Fett, das sich im Bauchraum um die inneren Organe ablagert, scheint dabei einen besonders schädlichen Einfluss auszuüben. Frauen ab 88 Zentimeter und Männer ab 102 Zentimetern Taillenumfang weisen ein stark erhöhtes Diabetesrisiko auf. Das Übergewicht verursacht eine Insulinresistenz, also eine verminderte Ansprechbarkeit der Muskel- und Fettzellen auf Insulin. Das Hormon ist beim Diabetes Typ 2 somit noch vorhanden, wirkt aber nicht mehr adäquat. Infolgedessen können die Körperzellen die Glucose aus dem Blut nicht mehr richtig aufnehmen, sodass der Blutzuckerspiegel steigt. Ein erhöhter Blutzuckerspiegel ist wiederum für die Bauchspeicheldrüse das Signal, vermehrt Insulin zu produzieren, um die Insulinresistenz zunächst zu kompensieren.
Das gelingt ihr auch einige Zeit. Das Anfangsstadium des Diabetes Typ 2 ist daher sogar durch erhöhte Insulinspiegel im Blut gekennzeichnet (Hyperinsulinämie) und der Blutzuckerspiegel liegt dabei nahezu im Normbereich. Im Laufe der Jahre lässt die Insulinproduktion jedoch nach, da sich die insulinproduzierenden Betazellen auf Dauer allmählich erschöpfen und somit den erhöhten Bedarf an Insulin nicht mehr decken können. Folglich beginnt der Insulinspiegel allmählich zu sinken, bis die Bauchspeicheldrüse die Produktion ganz einstellt und schließlich ein absoluter Insulinmangel und ein erhöhter Blutzuckerspiegel vorliegen.
Auf Spurensuche Ab einer Konzentration von 160 bis 180 Milligramm pro Deziliter (mg/dl) im Blut wird Glucose vermehrt mit dem Urin ausgeschieden (Glucosurie), da die Rückresorption in der Niere aus dem Primärharn („Nierenschwelle“) nicht mehr komplett möglich ist. Der Urin der Betroffenen wird „honigsüß“, worauf sich auch der Name der Krankheit Diabetes mellitus = honigsüßer Durchfluss (griech. Diabetes = Durchfluss, griech./lat. mellitus = honigsüß) bezieht. Mittels eines Glucoseteststreifens, der in den Morgenurin gehalten wird, kann der Patient selber erkennen, ob sich Zucker im Urin befindet.
Ein Nachweis über den genauen Glucosegehalt im Blut erfolgt über eine Messung des Blutzuckers. Dabei existieren mehrere Möglichkeiten. Die einfachere ist die Blutzuckermessung, die der Patient zu Hause im Schnelltestverfahren mit speziellen Teststreifen und einem Blutzuckermessgerät durchführt. Dafür gewinnt er mit einer Stechhilfe einen Tropfen Blut (Kapillarblut) beispielsweise aus der Fingerbeere oder dem Ohrläppchen, den er auf einen Teststreifen tropft. In wenigen Sekunden hat das Messgerät die aktuelle Blutglucosekonzentration ermittelt. Diese Nachweismethode dient aber nicht der Diagnose, sondern lediglich der Selbstkontrolle des Patienten.
Diagnosesicherung Um einen Diabetes eindeutig festzustellen, entnimmt der Arzt Blut aus der Vene. Die Blutzuckerbestimmung aus venösem Plasma ist auch der Weg, den die aktuellen Leitlinien der Deutschen Diabetes Gesellschaft (DDG) für die Diagnosestellung vorsieht. Die Blutzuckerwerte werden in Milligramm pro Deziliter (mg/dl) oder Millimol pro Liter (mmol/l) Blut angegeben. Dabei entsprechen 100 mg/dl = 5,6 mmol/l. Wurde dem Patienten nüchtern Blut abgenommen, liegt ein manifester Diabetes bei einem Plasma-Glucosewert von ≥ 126 mg/dl (7,0 mmol/l) vor. Zu beachten ist, dass für die Bestimmung des Nüchternblutzuckers vor der Blutentnahme eine mindestens zehn- bis zwölfstündige Nahrungspause liegen sollte.
Zudem wird die Diagnose Diabetes erst durch zwei Messungen bestätigt, um Fehlmessungen auszuschließen. Nüchternwerte zwischen 100 bis 125 mg/dl (5,6 bis 6,9 mmol/l) können auf eine Vorstufe eines Diabetes (Prädiabetes) hindeuten, bei der schon erhöhte Blutzuckerspiegel zu messen sind, die aber noch unterhalb der Grenzen zum Diabetes liegen. Häufig werden aber auch Gelegenheitsblut-Glucosewerte bestimmt, das heißt, der Patient war zum Zeitpunkt der Blutabnahme nicht nüchtern. Liegt dieser Gelegenheits-Plasma-Glucosewert > 200 mg/dl (11,1 mmol/l), kann auch hier die Diagnose Diabetes eindeutig gestellt werden. Gewissheit verschafft schließlich der Zuckerbelastungstest (oraler Glucosetoleranztest, oGGT).
Er ermittelt den Blutzuckerwert (oGTT-2-h-Wert), der zwei Stunden nach Gabe eines definierten Zuckergetränks gemessen wird (75 g Glucose in 250 bis 300 Milliliter Wasser innerhalb von 5 Minuten). Der Test erfolgt morgens nach einer 10- bis 16-stündigen Nahrungs- und Alkoholkarenz im Sitzen oder Liegen. Mindestens drei Tage zuvor sollte sich der Patient kohlenhydratreich ernährt haben. Werden im venösen Plasma oGTT-2h-Werte von mindestens 200 mg/dl (11,1 mmol/l) festgestellt, liegt ein Diabetes vor. Bei Werten zwischen 140 und 199 mg/dl (7,8 bis 11,1 mmol/l) spricht man von einer gestörten Glucosetoleranz.
Verlaufskontrolle Die Leitlinien sehen zur Diagnose auch die Verwendung des HbA1c-Wertes vor. Der HbA1c-Wert gibt an, wie viel Glucose sich im Blut an das Hämoglobin in den Erythrozyten angelagert hat. Diese „Verzuckerung“ ist umso ausgeprägter, je höher der Blutzuckerspiegel in den letzten Wochen war. Der Anteil des glykilierten Hämoglobins wird in Prozent oder in mmol/mol angegeben. Ein Diabetes liegt demnach bei einem HbA1c über 6,5 Prozent (48 mmol/mol) vor. Bei Werten unter 5,7 Prozent wird ein Diabetes ausgeschlossen. Während mit der Bestimmung des Blutzuckerwertes die aktuelle Stoffwechselsituation betrachtet wird, lässt der HbA1c-Wert also Rückschlüsse über die Einstellung des Stoffwechsels in der Vergangenheit zu und wird daher auch als Langzeit-Blutzucker oder Blutzuckergedächtnis bezeichnet.
Da die Lebensdauer der roten Blutkörperchen circa 120 Tage beträgt, kann mit der Bestimmung des glykilierten Hämoglobins eine Aussage über den Blutzuckerwert der letzten drei Monate gemacht werden. Dementsprechend sollte der Arzt vierteljährlich zur Verlaufskontrolle mit Messung des HbA1c-Wertes die Blutzuckereinstellung und somit den Behand- lungserfolg überprüfen. Um das Risiko für diabetische Folgeerkrankungen zu reduzieren, wird in der Regel bei Typ-1-Diabetikern ein HbA1c-Wert unter 7,5 und bei Typ-2-Diabetikern unter 6,5 Prozent angestrebt. Zu niedrige HbA1c-Werte sind nicht wünschens- wert, es können schwere Unterzuckerungen (Hypoglykämien) auftreten.
Sinkt der Blutzuckerspiegel unter 50 mg/dl beziehungsweise 2,8 mmol/l, liegt eine Hypoglykämie vor.
Krankheit mit Folgen Ein Problem erhöhter Blutglucosewerte ist eine irreversible Anlagerung des Zuckers an diverse Proteine im Blut. Durch die Glykilierung treten Gefäßerkrankungen mit nachfolgenden Durchblutungsstörungen auf. Je nach Größe der betroffenen Blutgefäße werden unterschiedliche Folgeerkrankungen unterschieden. Bei der diabetischen Mikroangiopathie sind kleine Gefäße betroffen, beispielsweise in den Augen, wo es zu Netzhautschäden kommt (Retinopathie), oder in den Nieren, was eine vermehrte Eiweißausscheidung mit fortschreitenden Nierenschäden bedingt (Nephropathie). Ebenso werden die Nerven in Mitleidenschaft gezogen, die zu Nervenschädigungen in allen Teilen des Nervensystems führen.
Typisches Beispiel ist die periphere Polyneuropathie der Diabetiker, die sich mit brennenden Fußsohlen, extremer Berührungsempfindlichkeit, Taubheitsgefühl sowie Missempfindungen oder nächtlichen Wadenkrämpfen bemerkbar macht. Ein besonderes Problem ist der diabetische Fuß, bei dem Gefäß- und Nervenschädigungen am Fuß Durchblutungs- und Gefühlsstörungen sowie eine verzögerte Wundheilung auslösen, die sich zu schwer therapierbaren Geschwüren entwickeln und eine Amputation erforderlich machen können. Schließlich ist noch die diabetische Makroangiopathie mit arteriosklerotischen Veränderungen an den mittleren und großen Arterien eine typische diabetische Folgeerkrankung, die mit gefährlichen Auswirkungen auf das Herz-Kreislaufsystem wie Herzinfarkt oder Schlaganfall einhergeht.
Tödlicher Symptomkomplex Nicht nur Folgeerkrankungen stellen sich ein. Bei einem übergewichtigen Typ-2-Diabetiker entwickeln sich häufig kurz zuvor oder nahezu zeitgleich ein Bluthochdruck und Fettstoffwechselstörungen. Da die einzelnen Krankheiten alle eng miteinander assoziiert und über das Übergewicht verbunden sind, spricht man bei ihrem gemeinsamen Auftreten vom metabolischen Syndrom oder tödlichen Quartett. Der Symptomkomplex gilt als der entscheidende Risikofaktor für Herz-Kreislauferkrankungen. Außerdem können sich die einzelnen Krankheiten gegenseitig verstärken und jede einzelne Gesundheitsstörung erhöht wiederum das Risiko für die Entwicklung eines Typ-2-Diabetes.
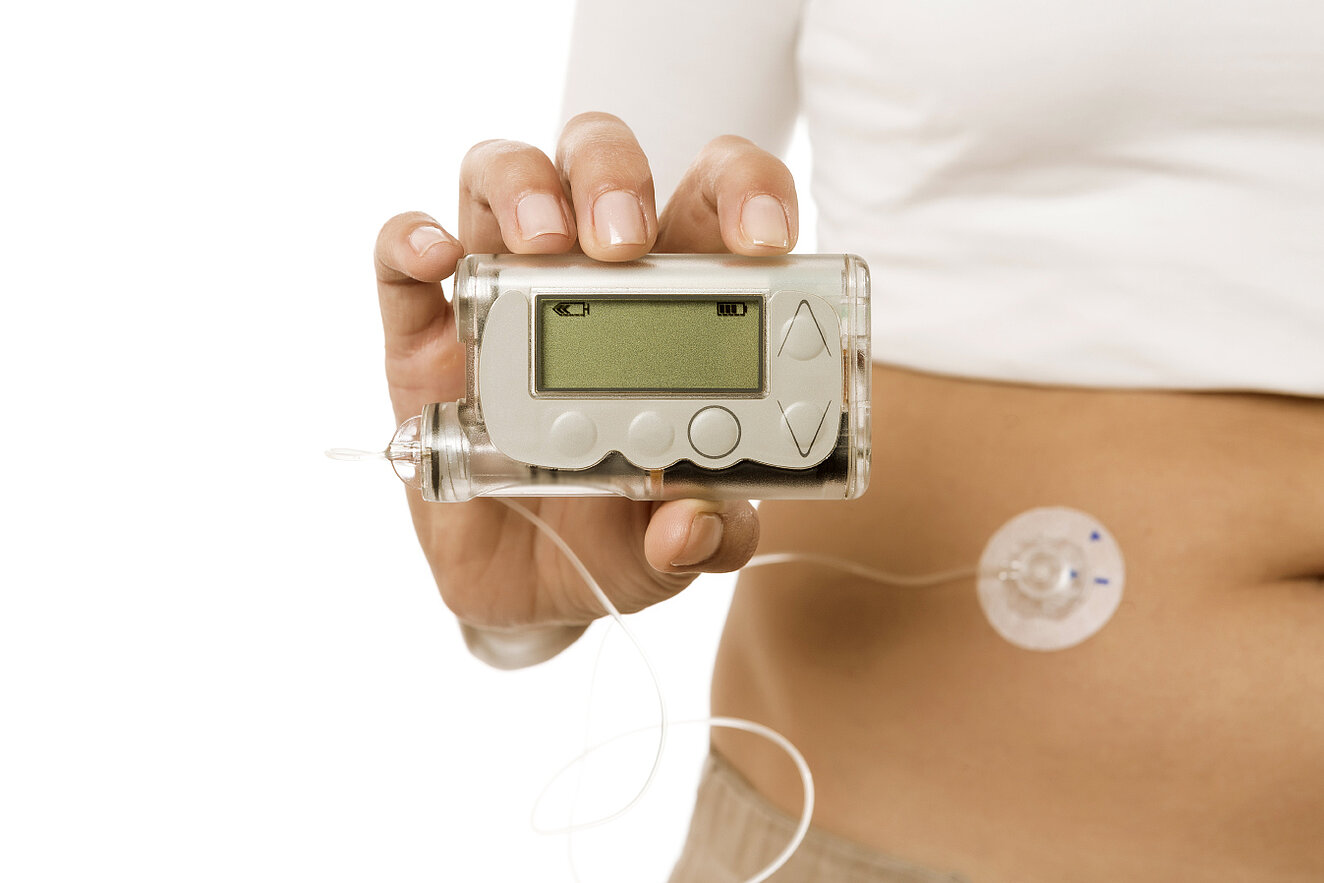
Insulinbehandlung Ziel jeder Diabetestherapie ist die Normalisierung des erhöhten Blutzuckers, um Komplikationen und diabetesassoziierte Folgeschäden zu vermeiden. Dafür ist beim Typ-1-Diabetiker das Spritzen von Insulin unverzichtbar. Da bei den meisten Diabetikern vom Typ 2 die körpereigene Insulinproduktion im Laufe der Jahre stark nachlässt, kann auch bei ihnen schließlich eine Insulingabe notwendig werden. Für die Insulintherapie stehen verschiedene Insulinzubereitungen zur Verfügung, die sich hinsichtlich ihres Wirkungseintritts, ihrer Wirkdauer und ihres Wirkungsmaximums unterscheiden.
Während früher Insulin aus tierischen Bauchspeicheldrüsen gewonnen wurde, stehen heute nur noch biotechnologisch hergestellte Humaninsuline (Normalinsulin) sowie davon abgewandelte Analoginsuline zur Verfügung. Diese Analoga zeichnen sich durch verschiedene Wirkprofile aus, die einen schnelleren Wirkeintritt (z. B. Lispro, Aspart, Glulisin) oder eine verlängerte Wirkdauer (z. B. NPH-Insuline, Detemir, Glargin) im Vergleich zu einem herkömmlichen Humaninsulin möglich machen. Zudem wird die Gefahr von Hypo- und Hyperglykämien verringert.
ICT- oder CT-Schema Beim Typ-1-Diabetes gilt die intensivierte Insulintherapie (Intensified Conventional Therapie, ICT), auch Basis-Bolus-Schema genannt, als Behandlungsstandard. Dabei wird der tägliche Insulinbedarf mit einem lang wirksamen Basalinsulin abgedeckt und mit einem kurz wirksamen Normal- oder Analoginsulin zu den Mahlzeiten kombiniert. Mit der ICT kann die Insulinzufuhr bedarfsgerecht erfolgen, sodass der Diabetiker seine Mahlzeiten flexibel gestalten kann. Die ICT wird zunehmend auch bei Diabetikern vom Typ 2 bevorzugt, da sie mit einer Risikoreduktion für mikrovaskuläre Folgeerkrankungen einhergeht. Notwendig wird sie laut Leitlinien, wenn der HbA1c-Wert trotz Einnahme oraler Antidiabetika über 7,5 Prozent liegt.
Dabei werden zunächst orale Antidiabetika mit Insulin kombiniert. Zur Nacht erhalten Betroffene in der Regel ein langwirksames Basalinsulin, um die Nüchtern-Blutzuckerwerte zu regulieren. Liegen die Blutzuckerwerte am Tage nicht im Zielbereich, kann zusätzlich die Injektion eines schnellwirksamen Insulins zum Essen erfolgen (prandiale Insulintherapie). Je nach Qualität der Blutzuckerwerte kann dann im weiteren Verlauf die Insulintherapie intensiviert werden.
Daneben kann bei einem Typ-2-Diabetiker die konventionelle Therapie (Conventional Therapie, CT) mit einer zweimal täglichen Insulingabe in fester Dosierung eine Alternative sein. Üblicherweise wird dafür ein Mischinsulin verwendet, das etwa 30 Minuten vor dem Frühstück und dem Abendessen gespritzt wird. Die CT erfordert den Verzehr von Haupt- und Zwischenmahlzeiten, um Hypoglykämien zu vermeiden. Dieses klassische Zweispritzen-Schema ist für den Typ-2-Diabetiker geeignet, der noch selber ausreichend Insulin produziert, um mit den eigenen Insulinreserven Blutzuckerschwankungen auszugleichen.
Orale Antidiabetika Metformin ist Mittel der ersten Wahl, möglichst zunächst als Monotherapie. Später kann es mit weiteren Antidiabetika kombiniert werden. Das Biguanid verbessert die Glucoseaufnahme im Fettgewebe und der Skelettmuskulatur und hemmt die hepatische Neubildung von Glucose. Da es nicht die Insulinsekretion stimuliert, besteht nur eine geringe Hypoglykämiegefahr. Zudem hat es einen günstigen Effekt auf das Körpergewicht. Hingegen führen orale Sulfonylharnstoffe (z. B. Glibenclamid, Glimepirid) zu einer Gewichtzunahme und sind daher nicht für adipöse Diabetiker geeignet. Sie binden an einen spezifischen Rezeptor auf der Betazelle und stimulieren so die Insulinausschüttung.
Gleichzeitig erhöhen sie das Risiko für Hypoglykämien. Zudem sollen sie die Erschöpfung der Betazellen beschleunigen. Das Risiko für Unterzuckerungen ist bei den nur kurz wirksamen Gliniden geringer. Auch sie stimulieren die endogene Insulinsekretion. Sie sind jedoch nur noch eingeschränkt (Repaglinid) oder gar nicht mehr (Nateglinid) verordnungsfähig. Keine Unterzuckerungen sind mit den Gliptinen (DPP-4-Hemmer, z. B. Sitagliptin, Vildagliptin, Saxagliptin) zu befürchten. Sie verstärken den Effekt der Inkretine, also der körpereigenen blutzuckersenkenden Darmhormone, ebenso wie die Inkretin-Mimetika (GLP-1-Agonisten, z. B. Exenatid, Liraglutid, Lixisenatid).
Letztere sind allerdings keine oralen Antidiabetika, denn sie werden zu festgelegten Zeiten subkutan ge- spritzt. Dapagliflozin, der erste Vertreter der neuesten Wirkstoffklasse, ist oral einzunehmen. Der SGLT-2-Inhibitor hemmt das Transportprotein SGLT-2, sodass weniger Glucose vom Primärharn ins Blut rückresorbiert wird. Zurzeit wird über eine Zulassungserweiterung für die Anwendung bei Diabetikern vom Typ 1 beraten, die nicht mit Insulin allein ihren Blutzuckerspiegel unter Kontrolle bekommen.
Den Artikel finden Sie auch in die PTA IN DER APOTHEKE 05/19 ab Seite 16.
Gode Chlond, Apothekerin












