Phagentherapie
KOMMEN DIE BAKTERIENFRESSER?
Seite 1/1 4 Minuten
Antibiotika haben herkömmlichen Infektionskrankheiten den Schrecken genommen, doch durch übertriebenen oder falschen Einsatz sowie durch fehlende Compliance haben sich gefährliche Resistenzen gebildet. Multiresistente Keime sind ein großes Problem in Krankenhäusern und Pflegeheimen, es gibt sogar schon Bakterien, die nicht einmal mehr auf Notfallantibiotika ansprechen. Die Erforschung neuer Wirkstoffe kann mit der Resistenzbildung nicht Schritt halten. Bald, so prophezeien Forscher, sind wir gegen eigentlich harmlose Infektionen machtlos. Bakteriophagen könnten dann eine Alternative sein.
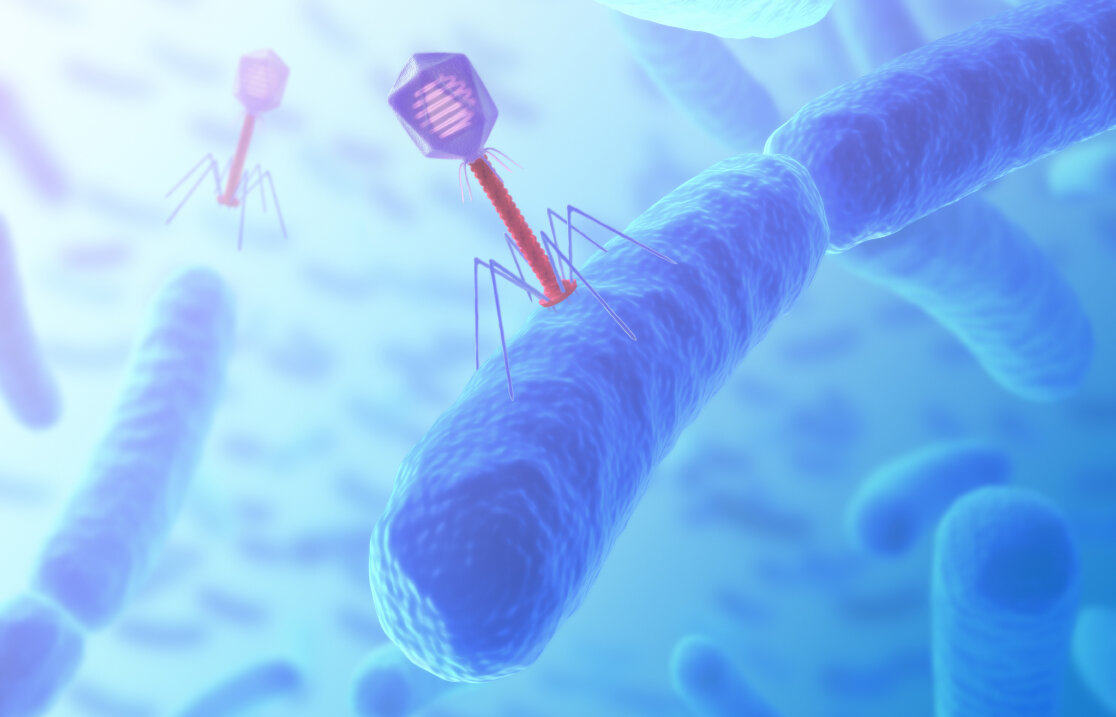
Biologische Schädlingsbekämpfer Im Gegensatz zu anderen Viren befallen Bakteriophagen (griechisch: „Stäbchenfresser“) keine Körperzellen, sondern Bakterien. Wie alle Viren können sie sich nicht alleine vermehren: Sie nutzen dafür den Syntheseapparat von Bakterien und Archaeabakterien, die danach absterben. Es gibt eine große Zahl von Phagenarten, die jeweils auf bestimmte Bakterienstämme spezialisiert sind. So existieren Phagen, die nur E.-coli-Bakterien befallen, ebenso wie solche, deren Leibspeise Salmonellen oder Diphteriebakterien sind. Phagen können sehr unterschiedlich gestaltet sein, ähneln aber meist kleinen Mondlandefähren, mit einem Kopf- und einem Schwanzteil, der „Landebeine“ aufweist.
Im Kopf befinden sich die Phagengene, die in Form von DNA oder RNA vorliegen können. Um ein Bakterium zu befallen, docken die Phagen mit ihren Landebeinen an Rezeptormolekülen auf der Bakterienoberfläche an, wobei jeweils nur die Rezeptoren des richtigen Bakterienstammes passen. Dann injizieren sie ihre Erbsubstanz aus dem Kopf in den Wirt. Diese übernimmt daraufhin das Kommando im Bakterium, das nun Phagenproteine und -erbsubstanz produziert, aus denen sich neue Phagen zusammenbauen. Ist dieser Prozess beendet, wird das Phagenenzym Lysozym gebildet, das die Zellwand des Bakteriums platzen lässt. Die neuen Phagen werden freigesetzt und können weitere Bakterien befallen.
Schon lange bekannt Dass man Phagen gegen Bakterien einsetzen kann, weiß man bereits seit rund 100 Jahren. Als Entdecker gilt der Kanadier Félix Hubert d’Hérelle, der im September 1917 eine „unsichtbare, dem Ruhr-Bazillus entgegenwirkende Mikrobe“ beschrieb. Er stellte fest, dass es winzige Parasiten geben musste, die die Keime zerstören und die er durch Filtration sogar aus einer Bakteriennährlösung isolieren konnte. 1919 isolierte D’Hérelle auf diese Weise zum ersten Mal Bakteriophagen aus Hühnerkot und bekämpfte damit den Hühnertyphus. Im selben Jahr wandte er die Phagentherapie auch erfolgreich bei einem Menschen an.
So begann die erfolgreiche Therapie mit den mysteriösen Partikeln, denn im Lichtmikroskop waren sie unsichtbar. Es sollte noch 20 Jahre dauern, bis man sie mit Hilfe des gerade erfundenen Elektronenmikroskops erkennen konnte. D’Hérelle widmete sein Leben der Phagentherapie. In Indien behandelte er das Brunnenwasser von Dörfern, in denen die Cholera ausgebrochen war, mit einer Phagensuspension. Dadurch konnte er die Sterblichkeit von 60 auf 8 Prozent reduzieren. 1933 lud Stalin ihn ein, seine Forschung in der georgischen Hauptstadt Tiflis weiterzuführen, wo er das Eliava-Institut für Phagenforschung gründete.
Ost gegen West Die Ost-West-Spaltung nach dem Zweiten Weltkrieg machte auch vor der Wissenschaft nicht Halt. Während im Westen durch das Aufkommen des Penicillins das Interesse an der Phagentherapie erlosch, setzte man im Osten aufgrund des Mangels an Antibiotika sowohl im Krieg als auch später darauf. Über tausend Mitarbeiter sollen im Eliava-Institut an Phagen zur Eindämmung von Typhus, Blutvergiftung und Durchfall gearbeitet und mit ihrer Hilfe vielen russischen Soldaten das Leben gerettet haben. Das Institut exisitiert auch heute noch, allerdings arbeiten in dem technisch desolaten Gebäude nur noch etwa 50 Menschen.
Eine Pharmafirma, die dort ebenfalls angesiedelt ist, stellt immer noch Bakteriophagenmittel als Suspension oder in Tablettenform her, die seit 2008 auch exportiert werden. Der Westen hat die Phagentherapie ebenfalls neu entdeckt, allerdings noch nicht vorrangig im medizinischen Sektor. Hier werden sie bisher hauptsächlich in der Lebensmittelsicherheit eingesetzt. Als Sprühnebel werden sie auf Würstchenpackungen und in Käseaufschnitt verteilt, um gefährliche Magen-Darm-Keime abzutöten. Doch der breite Nutzen der Bakteriophagen könnte tatsächlich in der Bekämpfung häufig auftretender Infektionskrankheiten liegen.
Neues altes Wundermittel? Bakteriophagen sind in der Regel auf einen oder wenige Bakterienstämme spezialisiert, manchmal sogar nur auf eine Art eines Stammes. Sie vermehren sich explosionsartig, sodass sie in kurzer Zeit viele Bakterien abtöten, und werden dann vom menschlichen Immunsystem eliminiert. Die Therapie ist also quasi selbstbegrenzend. Zudem mutieren Phagen genau so rasch wie Bakterien, sodass sich gegen resistent werdende Bakterien auch sofort erneut wirksame Phagen entwickeln.
Hat man einen Phagen gegen ein pathogenes Bakterium isoliert, eliminiert dieser den Erreger außerdem spezifisch, ohne die wichtigen und guten Haut- und Darmbakterien zu schädigen. Keine Nebenwirkungen also – und auch keine Allergien, denn unser Organismus ist Phagen gewohnt. Er ist dicht damit besiedelt, und wir nehmen über Wasser und Lebensmittel ständig neue auf. So viele Vorzüge haben sie gegenüber den herkömmlichen Antibiotika, dass man sich fragt, warum Bakteriophagen Antibiotika noch nicht abgelöst haben.
Grenzen der Therapie Tatsächlich ist jedoch gerade die hohe Spezifität ein Hindernis bei der Weiterentwicklung der Phagentherapie. Denn für jede Infektion muss zunächst der spezifische Phage isoliert werden, was wertvolle Zeit kosten kann, die ein Patient möglicherweise nicht hat. Man kann dann natürlich einen Cocktail aus bereits bekannten Phagen ausprobieren, er wird jedoch – wiederum aufgrund der hohen Spezifität – nicht so wirksam sein wie ein Breitbandantibiotikum. Außerdem muss jedes Arzneimittel einen langen Zulassungsweg durchlaufen. Jeden Phagen auf diesen Weg zu schicken ist unmöglich und im Sinne der Kosten-Nutzen-Ratio unsinnig. Diese Hürde trägt maßgeblich dazu bei, dass die Phagentherapie in Deutschland nur schleppend vorankommt.
Mittlerweile wird über eine Modellzulassung nachgedacht. Phagen sind nach der EU-Direktive 2001/83/EG auch nicht als Therapeutikum benannt, es gibt keine regulatorische Einordnung. Die Anwendung ist nicht illegal, aber sie bewegt sich in einer Grauzone und ist nicht durch klinische Studien abgesichert. So werden Phagentherapien in Georgien und Polen in bestimmten Fällen, wie etwa bei multiresistenten Keimen, weiterhin angewendet. Ein weiteres Problem sind Bakterien, die intrazellulär leben, zum Beispiel Borrelien oder Ehrlichien.
Diese können die Phagen nicht erreichen, da sie direkt an der Bakterienzellwand andocken müssen. Die Forschung ist hier auf dem Weg, Phagenenzyme zu isolieren, um die Bakterienlyse direkt auszulösen. Die weitere Entwicklung der Phagentherapie scheitert in Georgien an finanziellen Mitteln, im Westen hingegen an der mangelnden Erfahrung und starren Regulatorien. Doch die Notwendigkeit, eine Alternative zu den immer weniger wirksamen Antibiotika zu finden, könnte zu einem Umdenken führen.
Den Artikel finden Sie auch in die PTA IN DER APOTHEKE 01/19 ab Seite 26.
Dr. Holger Stumpf, Medizinjournalist